题目内容
14.以下物质可以通过化合反应及氧化还原反应制得的是( )①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
| A. | 全部 | B. | ①②③ | C. | ①②③④ | D. | ①②④⑥ |
分析 化合反应指由两种或两种以上的物质生成一种新物质的反应,氧化还原反应为有化合价变化的反应,据此分析判断.
解答 解:①氯化铁与铁反应生成氯化亚铁,Fe、Cl化合价发生变化,则属于氧化还原反应的化合反应,故①正确;
②铁与氯气化合生成氯化铁,Fe、Cl化合价发生变化,则属于氧化还原反应的化合反应,故②正确;
③Fe(OH)2不能通过化合反应得到,故③错误;
④氢氧化亚铁与氧气、水化合生成氢氧化铁,Fe、O化合价发生变化,则属于氧化还原反应的化合反应,故④正确;
⑤铜与硫化合生成硫化亚铜,不能生成CuS,则不能通过化合反应得到,故⑤错误;
⑥铝与硫单质反应生成硫化铝固体,Al、S化合价发生变化,则属于氧化还原反应的化合反应,故⑥正确;
故选:D.
点评 本题考查了元素化合物知识、化学反应类型等,难度不大,掌握元素化合物的知识是关键.

练习册系列答案
相关题目
13. 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )| A. | 该装置能量转化形式试点能转化为化学能 | |
| B. | 电子移动方向:电极a磷酸溶液电极b | |
| C. | 每有0.1mol O2反应,则向负极迁移的H+的物质的量为0.2mol | |
| D. | 负极反应式:CH2=CH2-2e-+H2O═CH3CHO+2H+ |
14. 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |
2.一定条件下,分别对反应C(g)+CO2(g)?2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO 的量.速率显著变大的是( )
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ①③ |
6.下列图示实验操作,能达到目的是( )
| A. |  检验K+的存在 检验K+的存在 | B. | 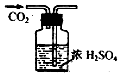 干燥CO2 | C. |  分离酒精与水 分离酒精与水 | D. |  蒸发食盐水 |
3.下列离子方程式书写正确的是( )
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | |
| D. | NaAlO2溶液和过量的HCl溶液反应:AlO2-+H++H2O═Al(OH)3↓ |
4. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 沸点:XH3<WH3 |

 ;
; ;
;