题目内容
16.某羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,该羧酸的分子式为( )| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |
分析 酯化反应中遵循原子守恒,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,还生成2molH2O,结合原子守恒来解答.
解答 解:羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,还生成2molH2O,由原子守恒可知,羧酸中含C原子为18-2×2=14,含H原子为26+2×2-2×6=18,含O原子为5+2-1×2=5,即羧酸的分子式为C14H18O5,
故选D.
点评 本题考查酯化反应,为高频考点,把握酯化反应的规律及生成水分子的个数为解答的关键,侧重分析与应用能力的考查,注意原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
8.可逆反应2SO2(g)+O2(g)?2SO3(g),下表中的数据为不同温度不同压强下的SO2转化率,由此判断下列图象错误的是( )
| 温度 | Pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
| A. |  | B. |  | C. | 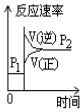 | D. |  |
9.下列关于Na2CO3和NaHCO3的叙述中,正确的是( )
| A. | NaHCO3俗名纯碱,Na2CO3俗名苏打 | |
| B. | 受热时,NaHCO3比Na2CO3容易分解 | |
| C. | NaHCO3溶液显酸性,Na2CO3溶液显碱性 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同 |
4. 25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
 25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )| A. | a=0.10 | |
| B. | N、P两点溶液中水的电离程度:N<P | |
| C. | M、N两点溶液中NH4+的物质的量之比大于1:2 | |
| D. | Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3•H2O) |
11.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同.下列化合物中同时存在离子键和共价键的是( )
| A. | Z2Y | B. | X2Y2 | C. | Z2Y2 | D. | ZYX |
1.实验室用如图装置制取少量乙酸乙酯,下列说法正确的是( )


| A. | 实验时向a中先加浓硫酸再加乙醇和乙酸 | |
| B. | 试管b中试剂为饱和NaOH溶液,可除去乙酸和乙醇 | |
| C. | 加入浓硫酸并加热起到了加快反应速率的作用 | |
| D. | 实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来 |
8.下列实验中,没有颜色变化的是( )
| A. | 葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热 | |
| B. | 淀粉溶液中加入碘酒 | |
| C. | 淀粉溶液中加入稀硫酸并加热 | |
| D. | 鸡蛋清中加入浓硝酸 |
5.实验室化学药品保存不当会失效,下列药品保存方法不当的是( )
| A. | 钠保存在广口瓶中并加煤油液封 | |
| B. | 新制氯水保存在棕色瓶中并置于冷暗处 | |
| C. | 氢氧化钠溶液保存在无色试剂瓶中并盖好玻璃塞 | |
| D. | 硫酸亚铁溶液存放在细口瓶中并加少量铁粉 |
6.仅用表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和四氯化碳的混合物 | 分液漏斗、烧杯、玻璃棒 |
| A. | A | B. | B | C. | C | D. | D |