题目内容
11.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同.下列化合物中同时存在离子键和共价键的是( )| A. | Z2Y | B. | X2Y2 | C. | Z2Y2 | D. | ZYX |
分析 短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同,Y为第二周期的非金属元素,Z为第三周期的金属元素,结合离子的电荷数可知,Y为O,Z为Na,X的原子序数为20-8-11=1,则X为H,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,
A.氧化钠只含离子键,故A不选;
B.过氧化氢只含共价键,故B不选;
C.过氧化钠含离子键、O-O共价键,故C选;
D.NaOH含离子键、O-H共价键,故D选;
故选CD.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、电子层结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意物质中化学键的判断,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
3.为研究哈伯法合成氨反应,T℃时,在容积为2L恒容容器中通入4mol N2和12mol H2,反应如下:
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
若25min时反应达到平衡,各物质浓度随时间变化曲线如图中甲、乙、丙.回答下列问题:

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
| N≡N | H-H | N-H | |
| 键能数据(KJ/mol) | 946 | 436 | x |

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
4.下列各项中表达正确的是( )
| A. | 硫离子(S2-)的核外电子排布式:1s22s22p63s23p6 | |
| B. | N2的结构式::N≡N: | |
| C. | NaCl的电子式: | |
| D. | CO2的分子模型示意图: |
1.用下列实验方案及所选玻璃仪器(非玻璃仪器任选>就能实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 海带提碘 | 将海带剪碎,加蒸馏水浸泡,取滤液加稀硫酸和H2O2 | 试管、胶头滴管、烧杯、漏斗 |
| C | 测定饱和NaClO溶液、CH3COONa溶液的pH值 | 分别蘸取两种溶液滴在pH试纸上,颜色稳定后与标准比色卡对照 | 玻璃捧、玻璃片 |
| D | 配制480ml0.5mol/LCuSO4溶液 | 将称量好的 62.5g CuSO4•5H2O 溶解、冷却、转移、洗涤、定容、摇匀 | 烧杯、玻璃棒、量筒、一定规格的容量瓶、胶头滴管 |
| A. | A | B. | B | C. | C | D. | D |
6.下列关于有机物的叙述中正确的是( )
| A. | 甲苯分子中所有原子均在同一个平面上 | |
| B. | 糖类、油脂、蛋白质在酸性条件下均可发生水解反应 | |
| C. | 分子式为C3H8O的有机物在浓硫酸、加热的条件下反应可能得到的有机产物有4种 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
16.某羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,该羧酸的分子式为( )
| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |
3.下列叙述正确的是( )
| A. | C5H11Cl有8种同分异构体 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
20.工业上,通常采用电解法处理酸性废水中的Cr2O72-,装置示意图如图所示.下列说法正确的是( )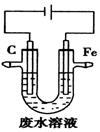

| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构. .
.