题目内容
5.实验室化学药品保存不当会失效,下列药品保存方法不当的是( )| A. | 钠保存在广口瓶中并加煤油液封 | |
| B. | 新制氯水保存在棕色瓶中并置于冷暗处 | |
| C. | 氢氧化钠溶液保存在无色试剂瓶中并盖好玻璃塞 | |
| D. | 硫酸亚铁溶液存放在细口瓶中并加少量铁粉 |
分析 A.钠化学性质比较活泼,能够与水发生反应,不能保存在水中;
B.氯水中氯气和水反应生成的次氯酸见光分解;
C.玻璃中二氧化硅和氢氧化钠溶液发生反应生成硅酸钠是一种矿物胶;
D.硫酸亚铁溶液易被氧化,溶液在细口瓶,加入铁粉防止被还原.
解答 解:A.钠性质活泼,需要隔绝空气密封保存,钠能够与水反应,不能保存在水中;由于钠密度大于煤油和石蜡,所以金属钠可以保存在煤油和石蜡中,故A正确;
B.氯水中氯气和水反应生成的次氯酸见光分解,新制氯水保存在棕色瓶中并置于冷暗处,故B正确;
C.玻璃中二氧化硅和氢氧化钠溶液发生反应生成硅酸钠是一种矿物胶,瓶口和瓶塞粘结不能打开,应是橡胶塞,故C错误;
D.硫酸亚铁溶液存放在细口瓶中并加少量铁粉防止被空气则氧气氧化,故D正确;
故选C.
点评 本题考查了化学试剂的保存方法判断,题目难度不大,注意掌握常见化学试剂的性质及正确保存方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
17.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH | |
| B. | CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | 2CH2=CH2+O2$→_{△}^{催化剂}$ |
16.某羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,该羧酸的分子式为( )
| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |
20.工业上,通常采用电解法处理酸性废水中的Cr2O72-,装置示意图如图所示.下列说法正确的是( )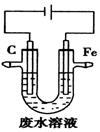

| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
10.下列可以说明钠的金属活动性比铝强的是( )
| A. | 切开金属钠,钠表面的银白色逐渐退去;打磨铝箔,铝箔表面很快生成新的氧化膜 | |
| B. | 相同条件下分别与足量盐酸反应时,1molNa和1molAl分别失去1mole-和3mole- | |
| C. | 钠和铝两种元素在自然界中均以化合态形式存在 | |
| D. | 相同条件下分别与足量盐酸反应时,Na和盐酸反应更快 |
17.下列有关物质的性质和用途均正确且有因果关系的是( )
| 选项 | 性质 | 用途 |
| A | Fe3+有氧化性 | 可用饱和FeCl3溶液制备Fe(OH)3胶体 |
| B | SiO2有导电性 | 可用SiO2制光导纤维 |
| C | NH3有还原性 | 可用NH3制取NO |
| D | 浓HNO3有酸性 | 可用铁制容器盛放浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
14.无机化合物按照组成和性质可进行如下分类:
(其中②、③、⑥均由Na、K、H、O、S中的3种元素组成)
(1)⑦能使品红溶液褪色且溶于水后形成弱酸,⑦的化学式是SO2,它过量排放到空气中会导致的环境问题是酸雨.
(2)上图“…”可以代表的物质类别是氧化物.
(3)①与③在水溶液中发生反应的离子方程式是H++OH-═H2O.
(4)②与⑥能发生复分解反应,则⑥的化学式是Na2SO3或K2SO3.
(5)酸、碱、盐在水溶液中发生复分解反应的条件是生成沉淀或气体或水.
  | ||||
| 酸 | 碱 | 盐 | … | |
| 实例 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3或K2SO3 | ⑦SO2 |
(1)⑦能使品红溶液褪色且溶于水后形成弱酸,⑦的化学式是SO2,它过量排放到空气中会导致的环境问题是酸雨.
(2)上图“…”可以代表的物质类别是氧化物.
(3)①与③在水溶液中发生反应的离子方程式是H++OH-═H2O.
(4)②与⑥能发生复分解反应,则⑥的化学式是Na2SO3或K2SO3.
(5)酸、碱、盐在水溶液中发生复分解反应的条件是生成沉淀或气体或水.
10.电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨).下列说法正确的是( )


| A. | 电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为4.4g (假设该过程中所有液体进出口密闭) | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电子由a经内电路流向b电极 | |
| D. | 图中b极连接电源的正极,C 口流出的物质是亚硫酸 |