题目内容
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
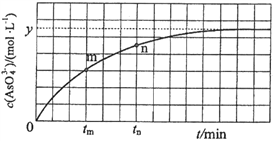
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:
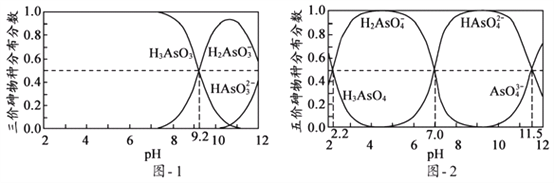
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
【答案】 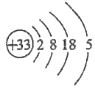 2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于
2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于 ![]() OH- + H3AsO3
OH- + H3AsO3![]() H2AsO3- + H2O 2.2
H2AsO3- + H2O 2.2
【解析】分析:(1)根据As的核外电子排布画出砷的原子结构示意图;
(2)根据电子得失守恒和原子守恒书写方程式;
(3)根据盖斯定律计算;
(4)①根据平衡状态的特征判断;
②根据tm时反应没有达到平衡状态,向正反应方向进行判断;
③根据浓度对反应速率的影响分析;
④根据平衡时离子的浓度结合平衡常数表达式计算;
(5)①根据图像结合溶液颜色变化判断产物;
②根据平衡常数表达式结合图中等浓度点计算。
详解:(1)砷为33号元素,原子结构示意图为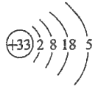 ;
;
(2)根据题干信息可知As2S3+O2→H3AsO4+S,As2S3化合价总共升高10价,利用得失电子守恒配平得:2As2S3+5O2→4H3AsO4+6S,再考虑质量守恒,反应前少了6O、12H,故方程式为2As2S3+5O2+6H2O=4H3AsO4+6S;
(3)已知:
①As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
②H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
根据盖斯定律可知①×1-②×3-③即得到反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=2△H1-3△H2-△H3;
(4)①a、溶液pH不变时,则c(OH—)也保持不变,能判断反应处于平衡状态,a错误;b、根据速率关系v(I—)=2v(AsO33—),则等式始终成立,不能判断反应处于平衡状态,b正确;c、由于提供的Na3AsO3总量一定,所以c(AsO43—)/c(AsO33—)不再变化,能判断反应处于平衡状态,c错误;d、c(I-)=y mol/L时,即c(AsO43)=c(I-),事实两者浓度关系一定是2c(AsO43)=c(I-),不能判断反应平衡状态,d正确,答案选bd;
②反应从正反应开始进行,tm时反应继续向正反应方向进行,故v逆小于v正;
③tm时比tn时,AsO43—浓度更小,所以逆反应速率也更小,tn时v逆大于tm时v逆;
④反应前,三种溶液混合后,Na3AsO3浓度为![]() ,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2)为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,则
,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2)为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,则![]() ;
;
(5)①从题图-1可知pH由小变大时,H3AsO3浓度减小,H2AsO3—浓度增大,当溶液由无色变为浅红色时,主要的离子反应应该为:OH-+H3AsO3=H2AsO3-+H2O;
②H3AsO4的第一步电离方程式为H3AsO4![]() H2AsO4-+H+,其电离常数Ka1=
H2AsO4-+H+,其电离常数Ka1=![]() ,由题图-2可知c(H3AsO4)=c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1=-lgKa1=-lg10-2.2=2.2。
,由题图-2可知c(H3AsO4)=c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1=-lgKa1=-lg10-2.2=2.2。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案