题目内容
15.下列说法正确的是( )| A. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| B. | 检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 | |
| C. | 浓HCl在与MnO2共热制取Cl2的实验中只起到还原剂的作用 | |
| D. | 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
分析 A.氯气的性质活泼,它与氢气在光照的条件下发生爆炸;
B.氯化氢、氯气都和硝酸银溶液反应生成白色沉淀;
C.依据反应中氯元素化合价变化解答;
D.氯气和氢氧化钠反应.
解答 解:A.氯气和氢气在光照条件下产生爆炸,故A错误;
B.氯气和水反应生成盐酸和次氯酸,氯化氢和硝酸银反应生成氯化银沉淀,所以氯气、氯化氢都能和硝酸银溶液反应生成白色沉淀,所以硝酸银溶液不能用于检验HCl气体中是否混有Cl2,故B错误;
C.反应中氯化氢中一部分氯化合价升高表现还原性,另一部分的HCl中的氯化合价不变,起到酸性的作用,故C错误;
D.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠溶液吸收氯气,防止污染环境,故D正确;
故选:D.
点评 本题考查了物质的性质,熟悉氯气的性质是解题关键,注意氯水的成分和性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.冬青油是一种无色液体,某实验小组利用如图1所示的装置制备冬青油.化学反应原理和实验装置如图2所示:
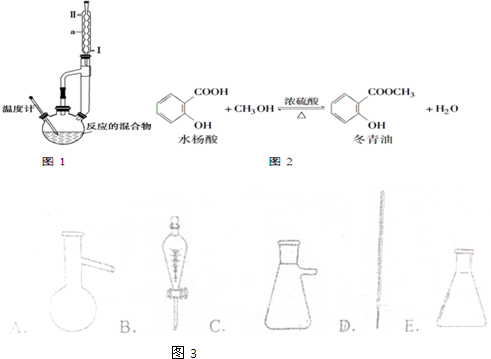
产物的有关数据如表所示:
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.

产物的有关数据如表所示:
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.
6.下列关于平衡常数的说法正确的是( )
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
3.下列方法可用于分离、提纯固态有机物的是( )
| A. | 蒸馏 | B. | 分馏 | C. | 重结晶 | D. | 萃取 |
10.下列有机化合物的分类不正确的是( )
| A. | 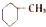 苯的同系物 | B. | 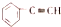 芳香烃 | C. |  卤代烃 | D. |  酯 |
7.下列反应中,能够说明乙烯分子具有不饱和键的是( )
| A. | 加成反应 | B. | 取代反应 | C. | 燃烧 | D. | 氧化反应 |
5.如表是元素周期表的一部分,针对表中的①-⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程 .
.
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程
 .
. 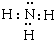 .
.