题目内容
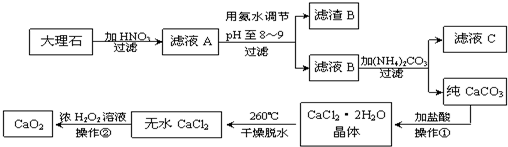
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
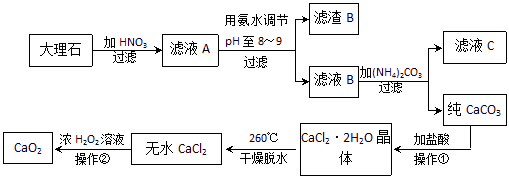 |
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+ (填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
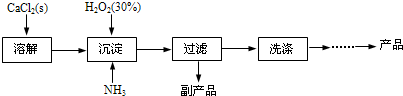
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。;用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为
(1)A、B、E (2分)
(2)除去Fe3+ (2分)
(3)是 (2分)
(4)< (2分)
(5)CaCl2+H2O2![]() CaO2+2HCl(或CaCl2+H2O2+2NaOH=CaO2↓+2NaCl+2H2O) (3分)
CaO2+2HCl(或CaCl2+H2O2+2NaOH=CaO2↓+2NaCl+2H2O) (3分)
加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。 (2分)
(6)25n/18am (2分)

 CaO2+2HCl
CaO2+2HCl