题目内容
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4a mol H2和2amol N2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升?秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
(1)N2(g)+3H2(g)  2NH3(g)+2(E3-E1)kJ/mol; 催化剂
2NH3(g)+2(E3-E1)kJ/mol; 催化剂
(2)0.01a/v ; 正向移动
(3)=;c(NH3)>c(NH2-)>c(Na+)>c(NH4+)
(4)B、D
解析试题分析:
(1)根据题意及图像可知该反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+2(E3-E1)kJ/mol;改变某一条件,降低了反应的活化能,使很多原来不能反应的分子变为活化分子,提高了活化分子的百分比率,反应速率加快。这是催化剂的作用。
2NH3(g)+2(E3-E1)kJ/mol;改变某一条件,降低了反应的活化能,使很多原来不能反应的分子变为活化分子,提高了活化分子的百分比率,反应速率加快。这是催化剂的作用。
(2)5分钟后测得N2的转化率为50%,则?n(N2)=amol,则?n(H2)=3amol,所以V(H2)= (?n(H2)÷v)÷ ?t="3amol÷" Vl÷5min×60s/min=0.01a/vmol/(L·s).根据反应方程式N2(g)+3H2(g)  2NH3(g)可知达平衡时各种物质的物质的量为n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此时再向该容器中投入a mol H2、amol N2和2amol NH3。相当于将容器的容积压缩至原来的一半。由于压强增大的影响大于浓度增大的影响,所以增大压强。化学平衡向气体体积减小的反应方向移动。由于该反应的正反应是气体体积减小的反应,所以在此时再向该容器中投入a mol H2、amol N2和2amol NH3,化学平衡向正反应方向移动。
2NH3(g)可知达平衡时各种物质的物质的量为n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此时再向该容器中投入a mol H2、amol N2和2amol NH3。相当于将容器的容积压缩至原来的一半。由于压强增大的影响大于浓度增大的影响,所以增大压强。化学平衡向气体体积减小的反应方向移动。由于该反应的正反应是气体体积减小的反应,所以在此时再向该容器中投入a mol H2、amol N2和2amol NH3,化学平衡向正反应方向移动。
(3)离子积K只与温度有关,而与其它条件无关。由于温度没变,所以K不会变化,还等于2×10-30。②在液氨中存在电离平衡2NH3 NH4++ NH2-。若将少量金属钠投入液氨中,发生反应2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破坏了电离平衡,促使NH3向电离的方向移动。最终达到平衡。由于NH3的电离程度是很微弱的。所以完全反应后所得溶液中各微粒的浓度大小关系为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
NH4++ NH2-。若将少量金属钠投入液氨中,发生反应2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破坏了电离平衡,促使NH3向电离的方向移动。最终达到平衡。由于NH3的电离程度是很微弱的。所以完全反应后所得溶液中各微粒的浓度大小关系为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
(4)在氨水中存在电离平衡:NH3·H2O NH4++OH-。用水稀释0.1mol/L稀氨水时。若平衡不移动,c(NH3?H2O)、c(NH4+)、c(OH-)都减小。但加水稀释时平衡向电离的方向移动,c(NH3?H2O)进一步减小,c(NH4+)、c(OH-)的浓度在减小的基础上又略有增加。但由于在溶液中存在水的电离平衡H2O
NH4++OH-。用水稀释0.1mol/L稀氨水时。若平衡不移动,c(NH3?H2O)、c(NH4+)、c(OH-)都减小。但加水稀释时平衡向电离的方向移动,c(NH3?H2O)进一步减小,c(NH4+)、c(OH-)的浓度在减小的基础上又略有增加。但由于在溶液中存在水的电离平衡H2O H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)减小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A错误。(NH3?H2O)/c(OH-)减小;B正确。C.c(H+)/c(NH4+)增大。错误。D.c(OH-)/c(H+)减小,正确。故选项为B、D。
H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)减小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A错误。(NH3?H2O)/c(OH-)减小;B正确。C.c(H+)/c(NH4+)增大。错误。D.c(OH-)/c(H+)减小,正确。故选项为B、D。
考点:考查氨气的热化学方程式的书写、液氨中的电离平衡、化学反应速率的计算、离子浓度的大小比较。

氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。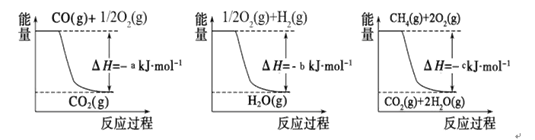
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 | |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示: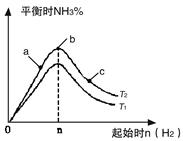
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
则50s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
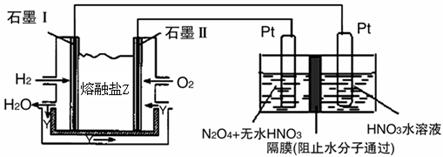
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) | 能量转化形式 |
| ① | 由化学能转化为热能 |
②Pb+PbO2+2H2SO4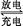 2PbSO4+2H2O 2PbSO4+2H2O | |
③CaCO3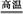 CaO+CO2↑ CaO+CO2↑ | |
上述反应中属于氧化还原反应的是(填序号) 。
作为国家正在实施的“西气东输”工程终点站——上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。
(1)目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民
开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量
烃类,天然气的主要成分是CH4,它们燃烧的化学方程式为:
2CO+O2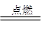 2CO2 2H2+O2
2CO2 2H2+O2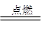 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 ,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是 。
(2)管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下:
| | 乙烷 | 丙烷 | 丁烷 |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是___________________________。
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。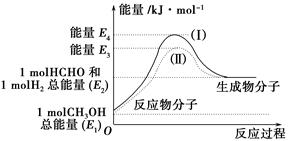
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是____________ ______________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式______________ _____________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+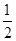 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。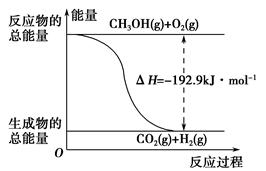
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+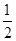 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%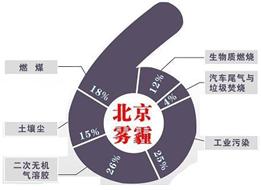
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |

 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示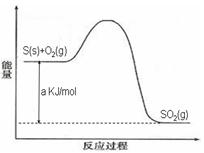
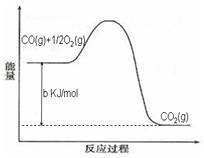
则用SO2除去CO的热化学方程式为 _____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。(4)利用ClO2氧化氮氧化物反应过程如下:

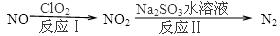
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。
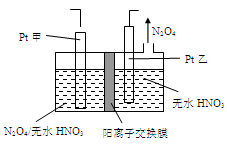
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 _____极,电解池中生成N2O5的电极反应式是________________。
 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
