题目内容
氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。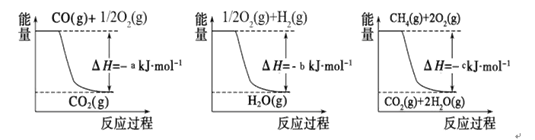
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 | |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
(16分)I.ΔH =(a+3b-c)( 3分)
Ⅱ.(1)c(3分);
(2)t > 5 (2分);
(3)0.2 mol·L-1·min-1(2分,数据1分,单位1分)
(4)c(3分);
(5)K= 4/81(3分)
解析试题分析:I.由图知CO(g)+1/2O2(g)=CO2(g)△H=-akJ/mol; ①
H2(g)+1/2O2(g)= H2O(g) △H=-bkJ/mol; ②
CH4(g)+2O2(g)= 2H2O(g)+ CO2(g) △H=-ckJ/mol ③;根据盖斯定律得方法②中反应的ΔH =③-①-②×3=-c-(-a)-(-b)×3=(a+3b-c)kJ/mol;
Ⅱ.(1)a、平衡时容器内N2、H2、NH3的浓度之比不一定为1︰3︰2,错误;b、根据化学方程式得3v(N2)正=v(H2)逆 ,错误;c、容器体积不变,一定温度下,随着反应的进行,气体的物质的量在减少,所以容器的压强逐渐减小,当平衡时,压强不再变化,正确;d、根据质量守恒定律,该恒容容器中的气体的密度一直不变,不能判断平衡状态的到达,错误,答案选c。
(2)甲与乙比,反应物的浓度小,所以反应速率慢,达平衡的时间长,则t>5min;
(3)氮气的初始浓度是4mol/L,平衡浓度是3mol/L,所以氮气的浓度减少1mol/L,则乙中氮气的平均反应速率为1mol/L/5min=0.2mol·L-1·min-1
(4)乙与甲比,乙的反应物浓度是甲的2倍,相当于在甲的平衡的基础上又充入3 mol H2、2 mol N2,若平衡不移动,则2c1 =3mol/L,ω1 = ω2,而实际在恒温恒容时增大反应物的浓度平衡正向移动,所以3>2c1,ω2 >ω1 ,ab错误;对于恒容条件下的可逆反应,体系中各物质均是气体,乙中的气体质量是甲中气体质量的2倍,所以乙的密度也是甲的2倍,c正确,答案选c。
(5)根据(3)的计算,消耗氮气1mol/L,消耗氢气3mol/L,则生成氨气2mol/L.该温度下,容器乙中各物质的平衡浓度分别为c(N2)=3mol/L,c(H2)=3mol/L,c(NH3)=2mol/L,所以
K= c(NH3)2/ c(N2)·c(H2)3=4/81(mol/L)-2
考点:考查盖斯定律的应用,化学反应速率的计算,化学平衡状态的判断,不同平衡状态的比较,化学平衡常数的计算

(14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正=" v" (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
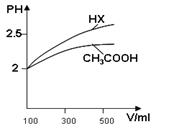
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO?)-c(Na+)=_________mol·L-1(填精确值)。
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。

如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
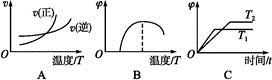
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g)
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。 (6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式__________________________________
(2)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l)
ΔH3=-285.8 kJ·mol-1
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4a mol H2和2amol N2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升?秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的 。请回答下问题;
。请回答下问题;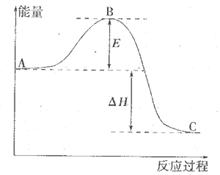
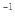 ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。