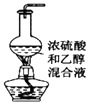
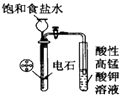
题目内容
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
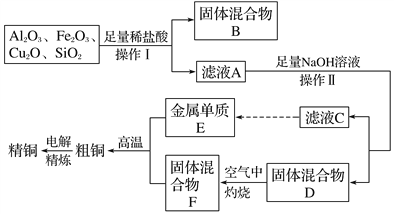
已知:Cu2O+2H+===Cu+Cu2++H2O。
(1)固体混合物B的成分是_________。它与NaOH溶液反应的离子方程式为_______________。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____________________,____________________________。设计要检验该铁元素的离子实验步骤为_____________________________________。
(3)在滤液C中通入足量CO2的离子方程式为________________。
【答案】 SiO2和Cu SiO2+2OH- = SiO32- + H2O Fe2+ Fe2O3+6H+ = 2Fe3++3H2O 2Fe3++Cu = 2Fe2++ Cu2+ 取少量的溶液于试管中,滴加KSCN,溶液不变红,再加氯水(或硝酸),溶液变红,则有Fe2+ 。(其他合理答案也可以) OH- + CO2 = HCO3-、AlO2- +CO2 +2H2O = Al(OH)3↓+HCO3-
【解析】Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Ai和Fe的混合物,经过电解可得纯铜。
(1)固体B为SiO2和Cu,它与NaOH溶液反应其中二氧化硅反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2和Cu; SiO2+2OH-=SiO32-+H2O;
(2)Cu2O与盐酸反应生成Cu和Cu2+,Fe2O3与盐酸反应生成Fe3+,Fe2O3+6H+=2Fe3++3H2O,反应生成Fe3+,与Cu反应生成Fe2+,2Fe3++Cu=2Fe2++Cu2+,有Cu剩余,则溶液中铁离子转化为亚铁离子,所以滤液A中铁元素的存在形式为Fe2+,检验铁离子时,可加入KSCN溶液,溶液变红色可证明,取少量的溶液于试管中,滴加KSCN,溶液不变红,再加氯水(或硝酸),溶液变红,则有Fe2+,故答案为:Fe2+;Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;取少量的溶液于试管中,滴加KSCN,溶液不变红,再加氯水(或硝酸),溶液变红,则有Fe2+;
(3)在滤液C中含氢氧化钠和偏铝酸钠溶液,通入足量CO2发生反应,生成碳酸氢钠,氢氧化铝,反应的离子方程式为:OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。

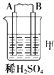
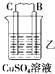
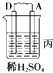
【题目】由A、B、C、D四种金属按下表中装置进行实验.
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 .
(2)装置乙中正极的电极反应式是 .
(3)装置丙中溶液的pH(填“变大”、“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是 .