题目内容
根据下图的转化关系判断下列说法正确的是(反应条件已略去)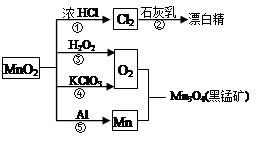
| A.反应①②③④⑤均属于氧化反应和离子反应 |
| B.反应⑤说明该条件下铝的还原性强于锰 |
| C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D.反应①中氧化剂与还原剂的物质的量之比为1:4 |
B
解析试题分析:A、氯酸钾分解、铝热反应不是离子反应,A不正确;B、金属铝的还原性强于锰,与二氧化锰发生铝热反应,B正确;C、反应③中每生成1mol氧气转移2mol电子,而反应④中每生成1mol氧气转移4mol电子,C不正确;D、实验室制备氯气的反应中氯化氢并没有完全被氧化,因此根据电子得失守恒可知反应①中氧化剂与还原剂的物质的量之比为1:2,D不正确,答案选B。
考点:考查离子反应、氧化还原反应的有关判断与计算以及铝热反应等

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子中,在强碱性溶液中能大量共存是
| A.Na+、HCO3-、CO32-、K+ | B.K+、Ba2+、Cl-、NO3- |
| C.Na+、NO3-、K+、S2- | D.K+、NH4+、SO42-、Cl- |
水溶液中能大量共存的一组离子是
| A.Na+、Ca2+、Cl-、SO42- |
| B.Fe2+、H+ 、SO32-、ClO- |
| C.Mg2+、NH4+、Cl-、SO42- |
| D.K+、Fe3+、NO3-、SCN- |
下列与化学概念有关的说法正确的是
| A.电解、电离的过程都需要消耗电能 |
| B.元素的非金属性越强,对应单质的活泼性一定越强 |
| C.有单质参加或生成的化学反应一定是氧化还原反应 |
| D.只含共价键的物质不一定是共价化合物 |
下列离子或分子组中大量共存且满足相应要求的是( )
| A.K+、AlO2-、Cl-、MnO4-要求:无色澄清溶液 |
| B.Fe3+、NO3-、I-、HCO3-要求:逐滴滴加盐酸立即产生气体 |
| C.Na+、K+、Ag+,NO3-要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| D.NH4+、Al3+、SO42-、CH3COOH要求:滴加NaOH浓溶液立刻产生气体 |
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
| A.Ca2+、K+、Cl-、SO32- | B.NH4+、Fe2+、 I一、SO42- |
| C.Na+ 、K+、ClO-、S2- | D.Na+、S2O32-、AlO2—、K+ |
在pH=1的溶液中,能大量共存的一组离子是( )
| A.Mg2+、Ca2+、HCO3-、NO3- | B.Al3+、NH4+、Br-、Cl- |
| C.K+、MnO4-、S2-、SO42- | D.Na+、K+、SiO32-、Cl- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
能正确表示下列反应的离子方程式为
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ ClO- + 2OH–= SO42-+Cl-+ H2O |
| C.硫化钡加入稀硫酸:BaS+ 2H+ = H2S↑+ Ba2+ |
| D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH–=2AlO2–+H2O |