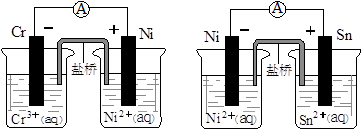
题目内容
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
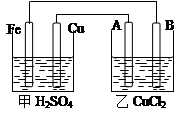
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
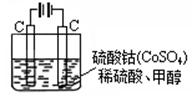
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:

①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ?mol-1
(2)①Co2+-e-=Co3+ ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(3)Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
(2)①Co2+-e-=Co3+ ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(3)Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
试题分析:(1)已知Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ?mol-1、Ⅱ:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ?mol-1,则依据盖斯定律Ⅰ+Ⅱ得到CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ?mol-1;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(3)以NaHCO3溶液为介质的Al-空气原电池中铝做负极失电子发生氧化反应生成铝离子,在碳酸氢钠溶液中水解相互促进生成氢氧化铝和二氧化碳;负极的电极反应式:Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目


 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )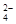 – 2e – = PbSO4
– 2e – = PbSO4