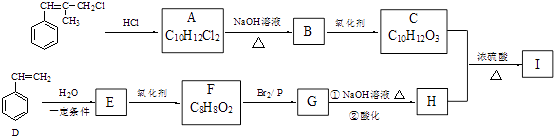
题目内容
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题. 
(1)同学甲设计实验检验废气A中含有CO2 , 应选择的试剂有 .
A.NaOH溶液
B.酸性KMnO4溶液
C.澄清石灰水
D.盐酸
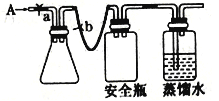
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如TU装置进行实验.
①为了保证实验成功,装置A应具有的现象是 , 搅拌的目的是 .
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算.经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 .
【答案】
(1)BC
(2)KMnO4溶液的紫红色不能完全褪色;提高SO2的吸收率;2H2SO3+O2=2H2SO4
【解析】解:(1.)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境,设计实验检验废气A中含有的CO2 , 需要除去二氧化硫,避免干扰二氧化碳的检验,除净二氧化硫的气体通过澄清石灰水检验二氧化碳的存在,石灰水变浑浊证明含有二氧化碳,所以A中为高锰酸钾溶液,B中为澄清石灰水,
故答案为:BC;
(2.)①为了保证实验成功需要在A装置中用高锰酸钾溶液全部吸收,高锰酸钾溶液不褪色证明二氧化硫吸收完全,搅拌的主要作用是充分吸收二氧化硫,提高吸收率,
故答案为:KMnO4溶液的紫红色不能完全褪色;提高SO2的吸收率;
②按照同学丙的实验,若废气中SO2完全被吸收,测定的结果应该偏大,可能是生成的亚硫酸被气体中氧气氧化,实验过程中发生2H2SO3+O2=2H2SO4 , 导致测定气体质量增大,
故答案为:2H2SO3+O2=2H2SO4 .
(1)设计实验检验废气A中含有的CO2 , 需要除去二氧化硫,避免干扰二氧化碳的检验,除净二氧化硫的气体通过澄清石灰水检验二氧化碳的存在;(2)①测定废气A中SO2的含量,为了保证实验成功需要在A装置中用高锰酸钾溶液全部吸收,高锰酸钾溶液不褪色证明吸收完全,搅拌的主要作用是充分吸收二氧化硫,提高吸收率;②测定的结果应该偏大,可能是生成的亚硫酸被气体中氧气氧化,气体质量增大.

 阅读快车系列答案
阅读快车系列答案【题目】下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是( )
选项 | W | X | Y | Z |
|
A | N2 | NH3 | NO | NO2 | |
B | Na | Na2O2 | NaOH | Na2CO3 | |
CC | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
A.A
B.B
C.C
D.D