题目内容
【题目】I是一种新型香料的主要成分之一,其结构中含有三个六元环.I的合成路线如下(部分产物和部分反应条件略去): 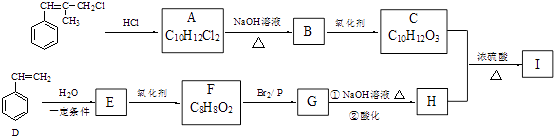
已知:①A中核磁共振氢谱图显示分子中有6种不同化学环境的氢原子.
② ![]()
③C和H是同系物
请回答下列问题:
(1)A→B的化学方程式为 .
D→E 的化学方程式为 .
(2)写出G分子中含有的官能团名称: .
(3)C和H生成I的反应类型为 .
(4)I的结构简式为 .
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的H的同分异构体有种(不包括立体异构),其中核磁共振氢谱为5组峰的为(写结构简式).
【答案】
(1) ;
;
(2)溴原子、羧基
(3)取代反应(酯化反应)
(4)
(5)9;![]()
【解析】解:  与氯化氢加成得A,A中核磁共振氢谱图显示分子中有6种不同化学环境的氢原子,根据A的分子式可知,A为
与氯化氢加成得A,A中核磁共振氢谱图显示分子中有6种不同化学环境的氢原子,根据A的分子式可知,A为  ,A在碱性条件下水解得B为
,A在碱性条件下水解得B为  ,B氧化得C为
,B氧化得C为  ,苯乙烯与水发生加成反应生成E,E可以氧化生成C8H8O2 , 说明E中羟基连接的C原子上有2个H原子,故E为
,苯乙烯与水发生加成反应生成E,E可以氧化生成C8H8O2 , 说明E中羟基连接的C原子上有2个H原子,故E为 ![]() ,F为
,F为 ![]() ,
, ![]() 与溴发生信息中的反应生成G为
与溴发生信息中的反应生成G为 ![]() ,G在氢氧化钠溶液条件下水解、酸化得到H为
,G在氢氧化钠溶液条件下水解、酸化得到H为 ![]() ,C与H发生酯化(取代)反应生成I,I结构中含有三个六元环,则I为
,C与H发生酯化(取代)反应生成I,I结构中含有三个六元环,则I为  ,
,
(1.)A→B的化学方程式为  ,D→E 的化学方程式为
,D→E 的化学方程式为  ,
,
所以答案是:  ;
;  ;
;
(2.)G为 ![]() ,G分子中含有的官能团名称为溴原子、羧基,
,G分子中含有的官能团名称为溴原子、羧基,
所以答案是:溴原子、羧基;
(3.)根据上面的分析可知,C和H生成I的反应类型为取代反应(酯化反应),
所以答案是:取代反应(酯化反应);
(4.)根据上面的分析可知,I的结构简式为  ,
,
所以答案是:  ;
;
(5.)H为 ![]() ,根据条件:①与FeCl3溶液发生显色反应,说明有酚羟基,②能发生水解反应,说明有酯基,③苯环上有两个取代基,则符合条件的H的同分异构体有苯环上连有﹣OH、CH3COO﹣,或﹣OH、HCOOCH2﹣,或﹣OH、﹣COOCH3 , 每种情况都有邻、间、对三种结构,所以共有9种,其中核磁共振氢谱为5组峰的为
,根据条件:①与FeCl3溶液发生显色反应,说明有酚羟基,②能发生水解反应,说明有酯基,③苯环上有两个取代基,则符合条件的H的同分异构体有苯环上连有﹣OH、CH3COO﹣,或﹣OH、HCOOCH2﹣,或﹣OH、﹣COOCH3 , 每种情况都有邻、间、对三种结构,所以共有9种,其中核磁共振氢谱为5组峰的为 ![]() ,
,
所以答案是:9; ![]() .
.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究. 
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 |
(1)NaCN溶液呈碱性的原因是(用离子方程式表示)
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN﹣+CO2+H2O=HCN+CO32﹣
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表HCOOH或HCN)
相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为 .
(4)探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN﹣的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4 , 关闭活塞.
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣
2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
处理含CN﹣废水时,如用NaOH溶液调节pH至9时,此时c(CN﹣)c(HCN)(填“>”、“<”或“=”)
(5)①和⑥的作用是 .
(6)反应结束后,缓缓通人空气的目的是 .
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置反应前后的质量(从装置①到⑥中选择,填装置序号).

