题目内容
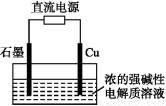
11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应放出11.46 kJ的热量,该反应的热化学方程式为 ,则KOH与H2SO4的中和热为 。
KOH(aq)+H2SO4(aq) K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 57.3 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 57.3 kJ·mol-1
【解析】n(KOH)=0.2 mol,n(H2SO4)=0.1 mol,两者恰好完全反应生成0.2 mol水,放出11.46 kJ的热量,由中和热的定义可知,生成1 mol水,放出的热量为11.46 kJ×5=57.3 kJ。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。