题目内容
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置.
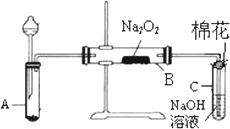
回答下列问题:
1、制取SO2的合适试剂是________.
a.80%的H2SO4(aq)
b.10%的H2SO4(aq)
c.Na2SO3(s)
d.Na2SO3(aq)
2、装置C中NaOH(aq)的作用是________.
3、移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式________.
4、检验反应后B装置中生成物的方法是________.
5、乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是________.按照乙同学的观点,该装置还需作如下改进:________.(简要阐述,并指明必需的装置名称与试剂.)
解析:
1、a、c(1分×2)
2、吸收多余的SO2,防止污染环境(1分×2)
3、SO2+Na2O2→Na2SO4(2分)
4、取少量B中固体于试管中,加盐酸至溶液呈酸性,再滴入氯化钡溶液,若有白色沉淀生成,则B中反应后的生成物里有Na2SO4(2分)
5、A中生成的SO2气体中含有水蒸气(2分). 在A和B之间连接一个装有浓硫酸的洗气瓶(或其他合适的干燥装置).合理给分.(2分)

 口算题天天练系列答案
口算题天天练系列答案大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉?KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
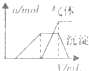
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是______________,不能确定的离子有________________。
(2)写出第一份试液滴加淀粉?KI溶液时发生反应的离子方程式:__________________。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:__________________________________、__________________________。
(4)设计实验方案,检验该酸雨中是否存在Cl-:___________________________________
______________________________。
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是________________________________________________________。

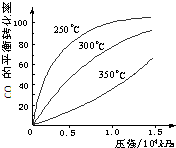 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.