题目内容
13.原子序数依次增大的X,Y,Z,W四种段周期元素,X,W原子的最外层电子数与其电子层数相等,X,Z的最外层电子数之和与Y,W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )| A. | 原子半径:W>Y>Z,而离子半径:Z>Y>W | |
| B. | 化合物丙中只存在共价键 | |
| C. | 测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 | |
| D. | 甲沸点远高于乙,可能是甲分子存在氢键所致 |
分析 原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,甲的化学式为YX3,是一种刺激性气味的气体,则甲是NH3,所以X是H元素、Y是N元素,W原子的最外层电子数与其电子层数相等且原子序数大于N,所以W是Al元素,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等,所以Z是F元素,丙是由X、Y、Z组成的盐,则丙是NH4F,结合物质的结构和性质解答.
解答 解:A.原子半径:F<N<Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径:Al3+<F-<N3-,故A错误;
B.由分析可知:化合物丙为NH4F,NH4F为含离子键,共价键的离子化合物,故B错误;
C.丙的水溶液呈酸性,说明阳离子水解大于阴离子水解程度,则溶液中丙盐阳离子浓度小于酸根离子浓度,故C错误;
D.由分析可知:甲是NH3,乙是NF3,NH3分子之间存在氢键,所以熔沸点相对较高,故D正确.
故选D.
点评 本题考查了元素位置结构性质的相互关系及应用,为高频考点,侧重于学生的分析能力的考查,根据原子结构确定元素,根据物质的性质及原子结构来分析解答,知道离子半径大小的比较方法,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
1.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
8.往浅绿色的Fe(NO3)2溶液中,逐滴加入HNO3时,溶液的颜色变化应该是( )
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
18.下列各组中的固体物质,只需加水就可以鉴别的一组是( )
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
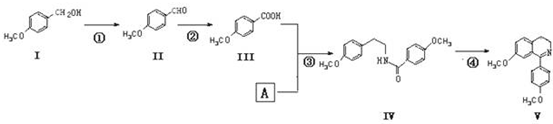
 .
.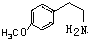 .
.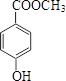 (或
(或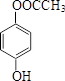 、
、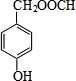 ).
).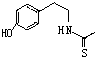 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为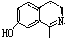 .
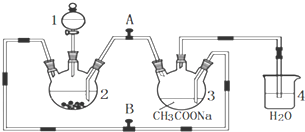
.
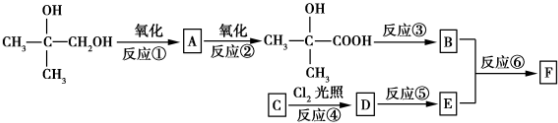
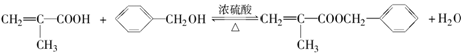 .
.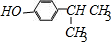 .
.