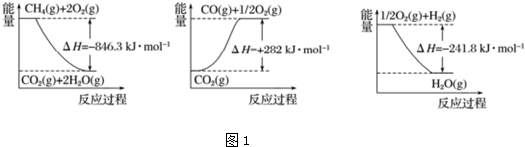
题目内容
3.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
分析 氧化性Br2>Fe3+可知:二价铁离子还原性强于溴离子,通入氯气,先氧化二价铁离子,剩余氯气再氧化溴离子.
A.氯气足量时,二价铁离子、溴离子都被氧化;
B.氯气少量先氧化二价铁离子;
C.氯气不足是,可以只氧化二价铁离子;
D.2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,氯气不足,把亚铁离子氧化成三价铁离子后,再部分氧化溴离子.
解答 解:A.氯气过量,Br-、Fe2+都完全被完全氧化,反应方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故A正确;
B.氯气少量先氧化二价铁离子,故B错误;
C.加入的氯气的物质的量与铁的物质的量1:2时,发生反应 2Fe2+-+Cl2═2Fe3++2Cl-,故C正确;
D.当加入的氯气把Fe2+完全氧化成Fe3+,还有部分剩余时,可以发生反应2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,故D正确;
故选:B.
点评 本题以氯气和溴化亚铁的反应为载体考查了氧化还原反应,明确溶液中离子反应的先后顺序是解本题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列物质是同学们生活中经常碰到的物质,其中属于纯净物的是( )
| A. | 水玻璃 | B. | 液氯 | C. | 漂白粉 | D. | 铝热剂 |
11.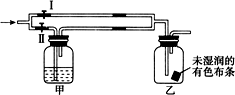 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
18.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
15.下列食品加工方法对人体无害的是 ( )
①用福尔马林浸泡海鲜防止鱼虾变质 ②香肠中加大量亚硝酸钠以保持肉类新鲜
③用“牛肉膏”将猪肉加工成牛肉 ④用“瘦肉精”(一种含激素的饲料)喂养生猪
⑤用小苏打做发酵粉制面包 ⑥向乳制品添加三聚氰胺以提高含氮量.
①用福尔马林浸泡海鲜防止鱼虾变质 ②香肠中加大量亚硝酸钠以保持肉类新鲜
③用“牛肉膏”将猪肉加工成牛肉 ④用“瘦肉精”(一种含激素的饲料)喂养生猪
⑤用小苏打做发酵粉制面包 ⑥向乳制品添加三聚氰胺以提高含氮量.
| A. | ②⑤ | B. | ⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
13.原子序数依次增大的X,Y,Z,W四种段周期元素,X,W原子的最外层电子数与其电子层数相等,X,Z的最外层电子数之和与Y,W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )
| A. | 原子半径:W>Y>Z,而离子半径:Z>Y>W | |
| B. | 化合物丙中只存在共价键 | |
| C. | 测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 | |
| D. | 甲沸点远高于乙,可能是甲分子存在氢键所致 |