题目内容
用双线桥分析下列氧化还原反应,并指出氧化剂还原剂①Fe+2HCl=FeCl2+H2↑ 氧化剂______还原剂______
②MnO2+4HCl
 MnCl2+Cl2↑+2H2O 氧化剂______还原剂______
MnCl2+Cl2↑+2H2O 氧化剂______还原剂______③2Na+2H2O=2NaOH+H2↑ 氧化剂______还原剂______.
【答案】分析:氧化还原反应中,化合价降低元素所在的反应物是氧化剂,该元素被还原,化合价升高元素所在的反应物是还原剂,该元素被氧化,化合价升高数=化合价降低数=转移电子数.
解答:解:①在反应Fe+2HCl=FeCl2+H2↑中,化合价降低元素是氢元素,所在的反应物HCl是氧化剂,化合价升高元素是铁元素,所在的反应物Fe是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: ;氯化氢;铁;
;氯化氢;铁;
②氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,这里的还原剂氯化氢部分(50%)被氧化,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: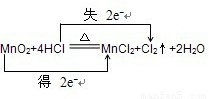 ;二氧化锰;氯化氢;
;二氧化锰;氯化氢;
③在反应2Na+2H2O=2NaOH+H2↑中,化合价降低元素是氢元素,所在的反应物水是氧化剂,化合价升高元素是钠元素,所在的反应物钠是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为: ;水;钠.
;水;钠.
点评:本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,较简单.
解答:解:①在反应Fe+2HCl=FeCl2+H2↑中,化合价降低元素是氢元素,所在的反应物HCl是氧化剂,化合价升高元素是铁元素,所在的反应物Fe是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
 ;氯化氢;铁;
;氯化氢;铁;②氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,这里的还原剂氯化氢部分(50%)被氧化,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
 ;二氧化锰;氯化氢;
;二氧化锰;氯化氢;③在反应2Na+2H2O=2NaOH+H2↑中,化合价降低元素是氢元素,所在的反应物水是氧化剂,化合价升高元素是钠元素,所在的反应物钠是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
 ;水;钠.
;水;钠.点评:本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,较简单.

练习册系列答案
相关题目


 Cu+H2O 还原剂______,氧化产物______,______;
Cu+H2O 还原剂______,氧化产物______,______;