题目内容
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
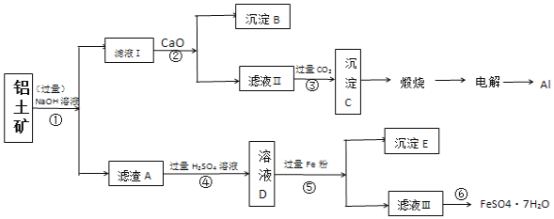
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
(5)滤液Ⅲ经过蒸发浓缩,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
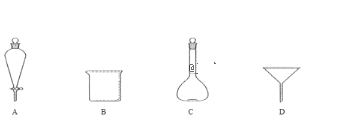
【答案】粉碎铝土矿(升高温度) AlO2-、SiO32- Fe+2Fe3+=3Fe2+ 加入KSCN溶液,无现象,再通入Cl2 ,产生血红色的络合物 冷却结晶 BD
【解析】
铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质),加入过量NaOH溶液,滤液Ⅰ含有偏铝酸钠、氢氧化钠以及硅酸钠,滤渣A含有铁的氧化物,滤液Ⅰ加入CaO,可生成硅酸钙沉淀,滤液Ⅱ含有偏铝酸钠,通入二氧化碳,生成氢氧化铝沉淀,经煅烧、电解,可得到铝;滤渣A加入稀硫酸,得到溶液D为硫酸铁、硫酸亚铁等,加入过量铁粉得到硫酸亚铁,经蒸发结晶得到FeSO4.7H2O。
(1)提高碱浸速率,可粉碎铝土矿(升高温度)等;
(2)由以上分析可知滤液Ⅰ中主要的阴离子是AlO2-,SiO32-;
(3)步骤⑤加入过量的铁粉可生成亚铁离子,除去铁离子,反应的离子方程式为Fe+2Fe3+=3Fe2+;
(4)滤液Ⅲ中的金属阳离子为亚铁离子,检验方法是加入KSCN溶液,无现象,再通入Cl2,产生血红色的络合物;
(5)滤液Ⅲ经过蒸发浓缩,冷却结晶,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有烧杯、漏斗等,故选BD。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目