题目内容
【题目】1.52 g铜镁合金完全溶解于50 mL 14 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.与铜镁合金反应的HNO3的物质的量为0.12 mol
【答案】B
【解析】
A.金属离子全部沉淀时,得到2.54克沉淀为氢氧化铜和氢氧化镁,故沉淀中的氢氧根离子的质量为2.54-1.52=1.02克,其物质的量为![]() ,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜和镁合金中铜和镁的物质的量分别为xmol、ymol,则有2x+2y=0.06 64x+24y=1.52,解x=0.02, y=0.01。则该合金中铜和镁的物质的量比为2:1,故正确;
,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜和镁合金中铜和镁的物质的量分别为xmol、ymol,则有2x+2y=0.06 64x+24y=1.52,解x=0.02, y=0.01。则该合金中铜和镁的物质的量比为2:1,故正确;
C.标况下1.12L气体的物质的量为![]() ,设混合气体中的二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol,四氧化二氮0.01mol,二氧化氮和四氧化二氮的混合气体中,二氧化氮的体积分数为
,设混合气体中的二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol,四氧化二氮0.01mol,二氧化氮和四氧化二氮的混合气体中,二氧化氮的体积分数为![]() =80%,故正确;B.50mL硝酸中含有硝酸的物质的量为14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据氮元素守恒,硝酸钠的物质的量为0.05L×14 mol/L -0.04 mol -(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为
=80%,故正确;B.50mL硝酸中含有硝酸的物质的量为14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据氮元素守恒,硝酸钠的物质的量为0.05L×14 mol/L -0.04 mol -(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为![]() ,故错误;
,故错误;
D.铜和镁的物质的量分别为0.02、0.01mol,则生成硝酸铜和硝酸镁各0.02 mol、0.01mol,二氧化氮和四氧化二氮的物质的量为0.05mol,含有二氧化氮0.04mol,四氧化二氮0.01mol,则消耗硝酸的物质的量为0.02×2+0.01×2+0.04+0.01×2=0.12mol,故正确。
故选B 。

【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:______。
(2)实验结果表明,催化剂的催化效果与_____有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是_____。

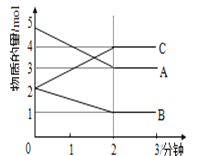
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
(4)该反应的的化学方程式为__________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)能说明该反应已达到平衡状态的是____。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数______。