题目内容
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。

(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl
 H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7(3)直接甲醇燃料电池结构如图所示,则负极反应是 。

(1)- 59.6 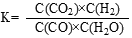
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此时催化剂亚铬酸锌的活性最大 或温度升高,反应速率增大
②促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
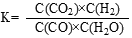
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此时催化剂亚铬酸锌的活性最大 或温度升高,反应速率增大
②促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
试题分析:(1)两个方程式相减,△H=-102.5-(-42.9)= - 59.6 kJ·mol-1;(2)催化剂一般有温度使用条件,保证其活性最大,反应速率最快,催化效果最好;(3)因为该反应生成难溶的CuCl固体覆盖在Cu表面阻碍反应继续进行,因此需要将CuCl固体溶解除掉,促使平衡正向移动;(4)该电池介质是酸性,负极为甲醇反应生成CO2,根据化合价的变化确定失去电子数目,电极反应式为CH3OH+H2O-6e-=CO2+6H+。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目


 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
 2NH3 (g) ΔH ="c" kJ? mol-1
2NH3 (g) ΔH ="c" kJ? mol-1

 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。

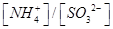 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”) 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。

 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L) O2(g)===CO(g) △H2
O2(g)===CO(g) △H2