题目内容
研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。

①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g)
 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中
 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)(14分)(1)77.3(2分)
(2)①<(2分) ② =(2分) ③ a b(2分) 0.08mol·L-1·min-1(2分)
(3)向左 (2分);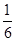 或0.17(2分)
或0.17(2分)
(2)①<(2分) ② =(2分) ③ a b(2分) 0.08mol·L-1·min-1(2分)
(3)向左 (2分);
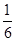 或0.17(2分)
或0.17(2分)试题分析:(1)根据热化学方程式2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol可知,每放出773kJ能量,反应中就转移12mol电子(氧气是氧化剂,1分子氧气得到4个电子),所以当该反应有1.2mol电子转移时,反应释放出的热量为
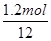 ×773kJ/mol=77.3kJ。
×773kJ/mol=77.3kJ。(2)①根据图像可知,在温度相同时,P2曲线表示的SO2转化率大于P1曲线表示的SO2转化率。由于正反应是体积减小的可逆反应,增大压强平衡向正反应方向移动,SO2转化率增大,所以压强是P1<P2。
②对于特定的可逆反应,平衡常数只与温度有关系,A、B两点的温度相同,所以两点对应的平衡常数相等。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据表中数据可知,反应前SO2和氧气的(0.4+1.6)mol/L=2.0mol/L和(1.2+1.6÷2)mol/L=2.0mol/L,即反应物的起始浓度不是按照化学计量数之比冲入的,所以当SO2和O2的体积比保持不变时,可以说明反应调动平衡状态,a正确;该反应是体积减小的可逆反应,所以容器内气体的压强是减小的,因此当压强不再发生变化时,可以说明达到平衡状态,b正确;密度是混合气的质量和容器容积的比值,在反应过程中气体的质量和容积始终是不变的,因此密度始终是不变的,因此选项c不能说明;根据S原子守恒可知,SO2和SO3物质的量之和始终保持不变,d不能说明,答案选ab。在0~10min内,氧气的浓度减少0.8mol/L,则υ(O2)=0.8mol/L÷10min=0.08mol·L-1·min-1。
(3)SO2溶于水生成亚硫酸,亚硫酸是酸,电离出氢离子,抑制水的电离,则溶液中水的电离平衡向左移动。根据亚硫酸的第二步电离方程式HSO3-+H2O
 SO32-+H+可知,Ka2=
SO32-+H+可知,Ka2=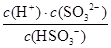 ,则
,则 =
= =
=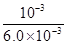 =
=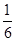 或0.17。
或0.17。
练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 2NO2(g) △H=+57.20kJ/mol。
2NO2(g) △H=+57.20kJ/mol。
 H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
 CH3OH(g) ΔH1
CH3OH(g) ΔH1



 2P2O5(s);ΔH1,
2P2O5(s);ΔH1, 2HI(g) - 26.5kJ
2HI(g) - 26.5kJ