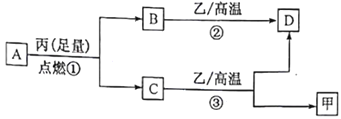
题目内容
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子式为__________________。
(2)关于乙烯基乙炔分子的说法错误的是:_________。
a. 能使酸性![]() 溶液褪色
溶液褪色
b. 1mol乙烯基乙炔能与3mol![]() 发生加成反应
发生加成反应
c. 乙烯基乙炔分子内含有两种官能团
d. 等质量的乙炔与乙烯基乙炔完全燃烧时耗氧量不相同
(3)1866年凯酷勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列_________事实(填入编号)。
a. 苯不能使溴水褪色 b. 苯能与![]() 发生加成反应
发生加成反应
c. 溴苯没有同分异构体 d. 邻二溴苯只有一种
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_______________。
【答案】C4H4 d ad ![]()
【解析】
(1)每个顶点上含有一个C原子,每个碳原子形成四个共价键,据此确定该物质分子式;
(2)乙烯基乙炔中含有碳碳双键、碳碳三键,具有烯烃和炔烃性质;
(3)根据双键能发生加成反应分析性质,根据BrCCBr和BrC=CBr两种不同的位置分析结构;
(4)环辛四烯的不饱和度为5,其同分异构体属于芳香烃,说明含有苯环,苯环的不饱和度为4,则苯环上取代基含有碳碳双键。
(1)每个顶点上含有一个C原子,每个碳原子形成四个共价键,所以该物质分子式为C4H4;故答案为:C4H4;
(2)a.该分子中含有碳碳双键、碳碳三键,具有烯烃和炔烃性质,所以能被酸性KMnO4溶液氧化而使酸性高锰酸钾溶液褪色,故正确;
b.碳碳双键和碳碳三键都能和溴单质发生加成反应,1mol碳碳双键完全加成需要1mol溴单质,1mol碳碳三键完全加成需要2mol溴单质,所以1mol乙烯基乙炔能与3mol Br2发生加成反应,故正确;
c.该分子中含有碳碳双键和三键,所以乙烯基乙炔分子内含有两种官能团,故正确;
d.乙炔和乙烯炔的最简式相同,所以等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同,故错误;
故答案为:d;
(3) 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,如果含有C=C键的话,则能发生加成反应而使溴水褪色,但真实的情况是苯不能使溴水发生反应而褪色,这一点不能解释;如果是单双建交替的正六边形平面结构,则邻二溴苯应有BrCCBr和BrC=CBr两种不同的结构,但事实是邻二溴苯只有一种,这一点也不能解释;故答案为:ad;
(4)环辛四烯的不饱和度为5,其同分异构体属于芳香烃,说明含有苯环,苯环的不饱和度为4,则苯环上取代基含有碳碳双键,所以环辛四烯符合条件的同分异构体为苯乙烯,其结构简式为![]() ;故答案为:
;故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成