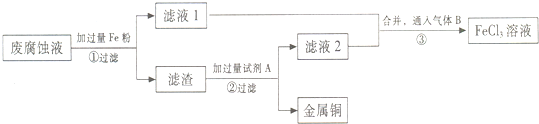
题目内容
19.下列关于实验安全的叙述中正确的( )| A. | 实验室制备有毒气体应在通风橱中进行,且对尾气进行吸收处理,防止中毒或污染大气 | |
| B. | 酒精灯不慎打翻小面积失火,可用湿抹布扑灭;实验室煤油大面积着火,可用水浇灭 | |
| C. | 氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 | |
| D. | 实验室,少量浓硫酸溅到皮肤上,应立即用碳酸钠溶液冲洗 |
分析 A.使用有毒气体,应避免中毒和污染;
B.酒精易溶于水,不能用水扑灭;
C.氢气还原氧化铜,应避免氢气不纯而爆炸;
D.浓硫酸稀释放热.
解答 解:A.使用有毒气体,应避免中毒,有毒气体应在通风橱中进行,为防止污染,必须对尾气进行吸收或处理,故A正确;
B.酒精易溶于水,不能用水扑灭,可用湿抹布盖灭,由于煤油不溶于水且密度比水小,故用水灭或会增大着火面积,故不能用水灭,应用沙土来灭,故B错误;
C.氢气还原氧化铜,应避免氢气不纯而爆炸,可先通入氢气,除去装置内空气,再点燃酒精灯加热,故C错误;
D.浓硫酸溅到皮肤上后,用碳酸钠溶液洗涤会造成浓硫酸的稀释,而浓硫酸稀释放热,会对皮肤造成二次伤害,故应先用干抹布擦去,然后图上碳酸氢钠溶液,故D错误.
故选A.
点评 本题综合考查实验操作的评价,侧重于实验安全的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,难度不大,注意把握实验操作的可行性和严密性的评价.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列各组中的离子,能大量共存的是( )
| A. | K+、H+、Cl-、CO32- | B. | K+、Cu2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | H+、Na+、OH-、Cl- | D. | Mg2+、Al3+、OH-、SO42- |
10.500mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量浓度为( )
| A. | 0.6mol/L | B. | 0.7mol/L | C. | 1.2mol/L | D. | 1.0mol/L |
14.金属在人类社会的发展进程中起着重要的作用.下列有关金属及其化合物的说法不正确的是( )
| A. | Fe、Mg、Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe3O4,H2O被还原生成H2 | |
| C. | 小苏打、氢氧化铝都可以用于中和胃酸 | |
| D. | 铝制餐具不适合长时间的蒸煮或长时间存放酸性、碱性或咸的食物 |
4.1.28g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为( )
| A. | 64g | B. | 64 | C. | 64 g/mol | D. | 32 g/mol |
11.根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c═4.18×10-3 kJ•g-1•℃-1,则该反应的中和热为△H=55.16.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
2.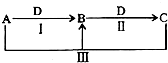 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )| A. | 若A为碳单质,则B可以用来灭火 | |
| B. | 若A为AlCl3,D为NaOH,则反应Ⅲ发生的是盐类双水解 | |
| C. | 若A为烧碱,D为CO2,则C的水溶液呈碱性 | |
| D. | 若A为氯水,D为日常生活中用途最广的金属单质,则I、Ⅱ、Ⅲ均是氧化还原反应 |