题目内容
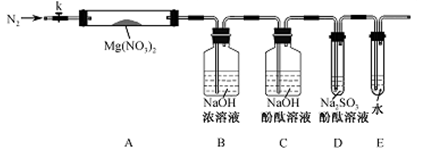
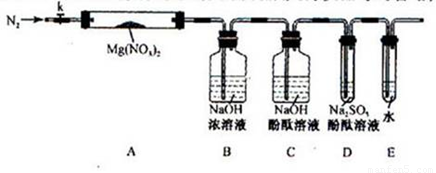
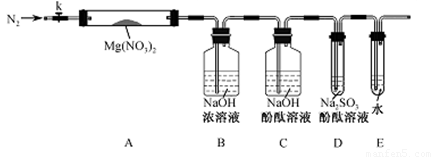
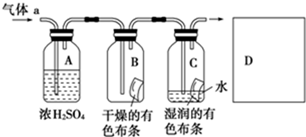 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.
请回答下列问题:
(1)浓硫酸的作用是______.
(2)证明氯气和水反应的实验现象为______.
(3)从物质性质的方面来看,这样的实验设计存在的缺陷为______,请用离子方程式表达图中D框克服事故隐患的措施______.
解:(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气,干燥氯气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,
故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为:Cl2+2OH-=Cl-+ClO-+H20;
故答案为:没有尾气吸收装置;Cl2+2OH-=Cl-+ClO-+H20.
分析:该实验是气体a通过浓硫酸干燥氯气,干燥的氯气通入B,不能使干燥的有色布条褪色,在通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查氯气的性质,氯气没有漂白性,氯水的漂白性是溶液中次氯酸的表现的性质.
故答案为:除去氯气中的水蒸气,干燥氯气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,
故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为:Cl2+2OH-=Cl-+ClO-+H20;
故答案为:没有尾气吸收装置;Cl2+2OH-=Cl-+ClO-+H20.
分析:该实验是气体a通过浓硫酸干燥氯气,干燥的氯气通入B,不能使干燥的有色布条褪色,在通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收:Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查氯气的性质,氯气没有漂白性,氯水的漂白性是溶液中次氯酸的表现的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目