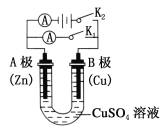
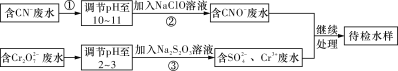
题目内容
【题目】标准状况下,将224L的HCl气体溶于815mL水中 (ρ=1.00g/cm 3), 所得盐酸的密度是1.18g/cm 3。
(1)取该盐酸10.0mL,稀释至250.0mL,所得稀盐酸的物质的量浓度?
(2)若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,(忽略混合时溶液体积变化),求混合后溶液中H+ 物质的量浓度?
【答案】(1)0.4mol/L;(2)8.4mol/L
【解析】
试题分析:n(HCl)=![]() =10mol,所得溶液的质量为:10mol×36.5g/mol+815ml×1.00g/ml=1180g,所得溶液的体积为:
=10mol,所得溶液的质量为:10mol×36.5g/mol+815ml×1.00g/ml=1180g,所得溶液的体积为:![]() =1000ml,即1L,则所得盐酸的物质的量浓度为:
=1000ml,即1L,则所得盐酸的物质的量浓度为:![]() =10mol/L。
=10mol/L。
(1)设所得稀盐酸的物质的量浓度为c,则有:0.01L×10mol/L=0.25L×c,解之得:c=0.4mol/L,故答案为: 0.4mol/L;
(2)密度为1.14g/cm3质量分数为20%的硫酸的物质的量为:n=![]() =1mol,若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,混合后的n(H+)=10mol+2mol=12mol溶液的体积为:1L+0.43L=1.43L,c(H+)=
=1mol,若将原盐酸溶液与430mL密度为1.14g/cm3质量分数为20%的硫酸混合,混合后的n(H+)=10mol+2mol=12mol溶液的体积为:1L+0.43L=1.43L,c(H+)=![]() =8.4mol/L,故答案为: 8.4mol/L。
=8.4mol/L,故答案为: 8.4mol/L。

练习册系列答案
相关题目