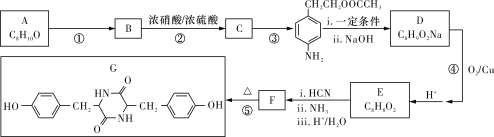
题目内容
【题目】请按要求回答下列问题。
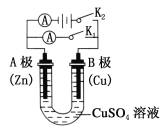
(1)①打开K2,合并K1。A电极可观察到的现象是_____________;B极的电极反应式为________________。
②打开K1,合并K2。A电极可观察到的现象是____________;B极的电极反应为________________________。
(2)判断原电池的正负极时,不仅要看金属活泼性顺序,还要注意此金属在电解质溶液中的活泼性。试回答下列问题:将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,负极是 ,若插入氢氧化钠溶液中形成原电池,负极是 。
【答案】(1)①锌不断溶解;Cu2++2e-=Cu ②电极表面有红色固体附着;Cu-2e-=Cu2+
(2)铜片 铝片
【解析】
试题分析:(1)①打开K2,合并K1,此时构成原电池,锌的金属性强于铜,锌是负极,铜是正极,则A电极可观察到的现象是锌不断溶解;B极的电极反应式为Cu2++2e-=Cu。
②打开K1,合并K2,此时构成电解池,锌电极与电源的负极相连,是阴极,溶液中的铜离子放电,则A电极可观察到的现象是电极表面有红色固体附着;B极是阳极,铜失去递增,则B电极反应为Cu-2e-=Cu2+。
(2)将铝片和铜片用导线连接,若插入浓硝酸中形成原电池,由于常温下铝在浓硝酸中钝化,则负极是铜片;若插入氢氧化钠溶液中形成原电池,由于铝能与氢氧化钠溶液反应,则负极是铝片

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目