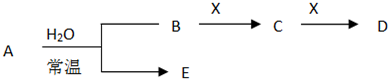题目内容
在一定条件下,可逆反应:mA+nB?pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n
(2)A、C是气体,增加B的量,平衡不移动,则B为
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使C的质量增加,则正反应是
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n
<
<
p(填“>”“<”或“=”)(2)A、C是气体,增加B的量,平衡不移动,则B为
固或液
固或液
态.(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
逆反应方向
逆反应方向
.(4)加热后,可使C的质量增加,则正反应是
吸热
吸热
反应(放热或吸热).分析:根据外界条件(浓度、温度、压强)对化学平衡的影响
解答:解:(1)因减小压强,平衡向气体体积增大的方向移动,所以m+n<p,故答案为:<;
(2)增加B的量,平衡不移动,说明B的浓度不变,可以是液体也可以是固体,故答案为:固或液;
(3)因增大压强,平衡向气体体积减小的方向移动,A、C是气体,而且m+n=p,所以B不是气体,则m<p,即平衡移动的方向是逆反应方向,故答案为:逆反应方向;
(4)因温度升高,平衡向吸热的方向移动,C的质量增加,说明正反应是吸热反应,故答案为:吸热.
(2)增加B的量,平衡不移动,说明B的浓度不变,可以是液体也可以是固体,故答案为:固或液;
(3)因增大压强,平衡向气体体积减小的方向移动,A、C是气体,而且m+n=p,所以B不是气体,则m<p,即平衡移动的方向是逆反应方向,故答案为:逆反应方向;
(4)因温度升高,平衡向吸热的方向移动,C的质量增加,说明正反应是吸热反应,故答案为:吸热.
点评:解答本题的关键是外界条件(浓度、温度、压强)对化学平衡的影响,然后对问题做出正确的判断.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列关于化学反应的速率和限度的说法正确的是( )
| A、化学反应速率通常只能用反应物浓度的减少量表示 | B、在一定条件下,可逆反应处于平衡状态时就达到了该反应的限度 | C、化学平衡状态指的是指化学反应不再进行的状态 | D、加入催化剂一定加快化学反应速率 |
 2NH3(g)已经达到平衡状态的是
2NH3(g)已经达到平衡状态的是 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有 N2O4(g)达到平衡状态的有
N2O4(g)达到平衡状态的有 CO(g)+H2(g)达到平衡状态的有
CO(g)+H2(g)达到平衡状态的有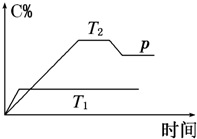 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题: