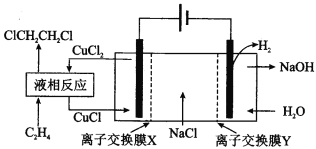
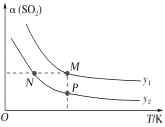
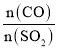题目内容
【题目】能正确表示下列反应的方程式的是( )
A.![]() 与水反应:
与水反应:![]()
B.![]() 溶液中加入
溶液中加入![]() 溶液:
溶液:![]()
C.铁粉和水蒸气反应: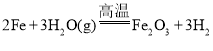
D.含有![]() 的溶液中,通入
的溶液中,通入![]()
【答案】D
【解析】
A.Cl2与水反应的离子方程式:Cl2+H2O═H++HClO+Cl-,故A错误;
B.CuSO4溶液中加入Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C.铁粉和水蒸气反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2,故C错误;
Fe3O4+4H2,故C错误;
D.含有1molFeBr2的溶液中,通入1molCl2,首先氧化亚铁离子,剩余的氯气再氧化溴离子,离子方程式:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl-,故D正确;
故选D。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
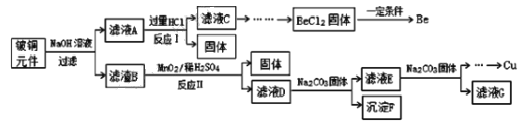
开心蛙口算题卡系列答案【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。