题目内容
【题目】(1) 一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,该晶体中原子之间的作用力是_____________。
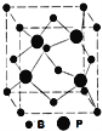
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为______.
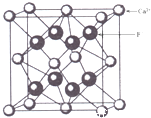
(3)立方BP(磷化硼)的晶胞结构如图所示,晶胞中含B原子数目为_____________ 。
(4)科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示。该化合物中的K原子和C60分子的个数比为_____________________ 。

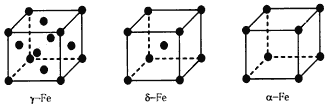
(5)铁有γ、δ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为__________。
【答案】3:1 金属键 Cu3AuH8 4 3∶1 4 4∶3
【解析】
(1)根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
(2)CaF2的结构如图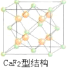 ,利用均摊法计算;
,利用均摊法计算;
(3)根据均摊法计算;
(4)根据均摊法计算晶胞中K原子、C60分子数目,确定数目之比;
(5)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值。
(1)铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×![]() =3,晶胞中Au原子数目=8×
=3,晶胞中Au原子数目=8×![]() =1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
=1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
(2)CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
(3)晶胞中B原子位于顶点和面心,数目为8×![]() +6×
+6×![]() =4;
=4;
(4)晶胞中K原子数目=2×6×![]() =6、C60分子数目=1+8×
=6、C60分子数目=1+8×![]() =2,故晶胞中K原子、C60分子数目之比=6:2=3:1;
=2,故晶胞中K原子、C60分子数目之比=6:2=3:1;
(5)γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。

 优学名师名题系列答案
优学名师名题系列答案【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度