题目内容
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)  2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
① 5 min内该反应的平均速率υ(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a. 混合气体的密度 b. 混合气体的压强
c. 正反应速率 d. 单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) ?H =" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ?H = -571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 。
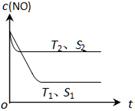
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的?H 0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线。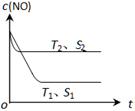
(1)① 0.2 mol·L-1·min-1 1.25 (3分)
② c d
(2)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) ?H = -752.1 kJ·mol-1(3分)
(3)① <
②

【解析】
试题分析:(1)①υ(NO)="△c(NO)÷t=△n(NO)" ÷V÷t="5min÷5L÷5min=" 0.2 mol·L-1·min-1。
利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量。
N2(g)+O2(g) 2NO(g),
2NO(g),
起始(mol):6.5 mol 7.5 molO2 0
反应(mol):2.5mol 2.5mol 5mol
平衡(mol):4mol 5mol 5mol
平衡常数K =[c(NO)]2÷c(N2)÷c(O2)="(" 5mol/5L)2÷(5mol/5L) ÷( 4mol/5L)= 1.25。
②a、质量守恒、容器体积不变,故密度一直不变,故a错误;
b、该反应是反应气体体积不变的反应,所以无论反应是否达到平衡状态,体系的压强始终不变,故b错误;故选cd。
(2)由第二个式子减去第一个式子,得出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式,即2H2(g) + 2NO(g) = N2(g) + 2H2O(l) ?H = -752.1 kJ·mol-1。
(3)①由图可知T2>T1,升高温度c(NO)增大,即正反应是吸热反应,故△H<0。
考点:化学平衡的影响因素 用盖斯定律进行有关反应热的计算 化学平衡常数的含义 用化学平衡常数进行计算
点评:本题考查了化学平衡的有关计算、反应热的计算等知识点,根据三段式法进行化学平衡的有关计算、根据物质的量与热量的关系式计算放出的热量即可,注意化学平衡常数有温度有关,与化学反应方程式的书写有关,为易错点。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 KJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H2=+172.5KJ·mol-1
则△H= KJ•mol-1。
(2)高炉炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
(4)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为 。
 (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一. 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。