题目内容
3.下列说法正确的是( )| A. | 人类在研究物质微观结构过程中,电子显微镜、光学显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了应用 | |
| B. | 意大利科学家阿佛加德罗在1888年总结出平衡移动原理 | |
| C. | 用于比色分析的分光光度计可用来测定反应速率 | |
| D. | pH试纸有广范和精密两种,广范pH试纸测量范围较广,测量精度较高 |
分析 A、扫描隧道显微镜可观察到的粒子直径最小,使用时间最晚;
B、阿佛加德罗提出了分子的概念,奠定了近代化学的基础;
C、可以借助分光光度计采用比色的方法测定某反应的化学反应速率;
D、精密pH试纸的精密度较高.
解答 解:A、光学显微镜距离直接观察原子和分子实在太遥远了,而电子显微镜虽然比光学显微镜前进了一大步,但是离开直接观察原子和分子还有一段距离.20世纪80年代初发展起来的扫描隧道显微镜是使人们能够直接观察和研究物质微观结构的新型显微镜,故A正确;
B、意大利科学家阿佛加德罗提出了分子的概念,奠定了近代化学的基础,勒夏特列总结出平衡移动的原理,故B错误;
C、测定某反应的化学反应速率可以借助分光光度计采用比色的方法测定,故C正确;
D、pH试纸有广范和精密两种,广范pH试纸测量范围较广,但精密pH试纸的精密度较高,故D错误.
故选C.
点评 本题考查较为综合,涉及化学研究方法等知识,为高频考点,侧重于化学与生活、环境的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
20.下列溶液中的,c(Cl-)与50mL、1mol/L的 AlCl3溶液中c(Cl-)相等的是( )
| A. | 75mL 1mol/L的FeCl3溶液 | B. | 75mL 2mol/L 的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L 的KCl溶液 | D. | 150mL 1mol/L 的NaCl溶液 |
11.根据以下几个反应:
①Cl2+2KI═2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2KI═2FeCl2+2KCl+I2
判断氧化性由强到弱的顺序是( )
①Cl2+2KI═2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2KI═2FeCl2+2KCl+I2
判断氧化性由强到弱的顺序是( )
| A. | Cl2>I2>Fe3+ | B. | Cl2>Fe3+>I2 | C. | Fe3+>Cl2>I2 | D. | Fe3+>I2>Cl2 |
18.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M.关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1mol As,反应中转移电子的物质的量为3mol
④M为OH-⑤SnCl62-是氧化产物.
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1mol As,反应中转移电子的物质的量为3mol
④M为OH-⑤SnCl62-是氧化产物.
| A. | ①②④⑤ | B. | ①③⑤ | C. | ①②③④ | D. | 只有①③ |
8.常温下,下列溶液中,能大量共存的一组离子是( )
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 通入CO2气体的溶液中:Ca2+、I-、ClO-、NO3-、 | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
15. 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,O2-在熔融盐中从右往左迁移 | |
| B. | 阳极电极反应式为2O2--4e-=O2↑ | |
| C. | 阳极每产生4.48L的O2,理论上能生成0.2mol钛 | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
12.向阳中学高二某小组同学设计并进行了一系列有关Fe2+与Fe3+的相关实验.
请回答下列问题:
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
13.下列说法中,不正确的是( )
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
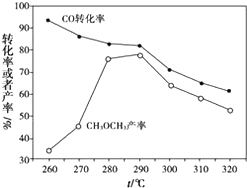 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应: