题目内容
11.根据以下几个反应:①Cl2+2KI═2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2KI═2FeCl2+2KCl+I2
判断氧化性由强到弱的顺序是( )
| A. | Cl2>I2>Fe3+ | B. | Cl2>Fe3+>I2 | C. | Fe3+>Cl2>I2 | D. | Fe3+>I2>Cl2 |
分析 根据反应中元素化合价的降低来分析氧化剂,然后利用氧化剂的氧化性大于氧化产物的氧化性来比较.
解答 解:氧化还原反应中氧化性:氧化剂>氧化产物.由反应①得氧化性:Cl2>I2;由反应②得氧化性:Cl2>Fe3+;由反应③得氧化性:Fe3+>I2.综上所述知,氧化性Cl2>Fe3+>I2.故选B.
点评 本题考查氧化性的比较,明确氧化还原反应中元素的化合价变化及氧化剂的氧化性大于氧化产物的氧化性是解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.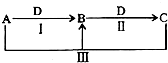 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )| A. | 若A为碳单质,则B可以用来灭火 | |
| B. | 若A为AlCl3,D为NaOH,则反应Ⅲ发生的是盐类双水解 | |
| C. | 若A为烧碱,D为CO2,则C的水溶液呈碱性 | |
| D. | 若A为氯水,D为日常生活中用途最广的金属单质,则I、Ⅱ、Ⅲ均是氧化还原反应 |
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石比石墨稳定 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
6.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 标准状况下,22.4LSO3含有NASO3个分子 | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 常温常压下,0.1molCl2溶于水,转移的电子数目为0.1NA |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol/LNa2S溶液中所含S2-总数小于O.1NA | |
| B. | 若CH3COONa溶液中CH3COO-的数目为NA,则Na+的数目大于NA | |
| C. | 一定条件下,1mol N2和3 mol H2混合充分反应,转移的电子数目为6NA | |
| D. | 标准状况下,11.2 L己烷中含有的化学键数目为9.5NA |
3.下列说法正确的是( )
| A. | 人类在研究物质微观结构过程中,电子显微镜、光学显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了应用 | |
| B. | 意大利科学家阿佛加德罗在1888年总结出平衡移动原理 | |
| C. | 用于比色分析的分光光度计可用来测定反应速率 | |
| D. | pH试纸有广范和精密两种,广范pH试纸测量范围较广,测量精度较高 |
1.下列离子方程式正确的是( )
| A. | 稀硫酸与氢氧化铜反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 碳酸钙与盐酸反应:CO32 -+2H+═H2O+CO2↑ | |
| D. | 碳酸钾与硝酸:CO32-+2H+═H2O+CO2↑ |
