题目内容
20.下列溶液中的,c(Cl-)与50mL、1mol/L的 AlCl3溶液中c(Cl-)相等的是( )| A. | 75mL 1mol/L的FeCl3溶液 | B. | 75mL 2mol/L 的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L 的KCl溶液 | D. | 150mL 1mol/L 的NaCl溶液 |
分析 溶液中电解质离子的浓度与溶液体积无关,电解质溶液中离子浓度=电解质浓度×化学式中相应离子数目,50mL、1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
解答 解:50mL、1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A.75mL 1mol/L的FeCl3溶液中Cl-浓度为1mol/L×3=3mol/L,故A符合;
B.75mL 2mol/L 的NH4Cl溶液中Cl-浓度为2mol/L×1=2mol/L,故B不符合;
C.100mL 1.5mol/L 的KCl溶液中Cl-浓度为1.5mol/L×1=1.5mol/L,故C不符合;
D.150mL 1mol/L 的NaCl溶液中Cl-浓度为1mol/L×1=1mol/L,故D不符合,
故选:A.
点评 本题考查物质的量浓度的计算,题目难度不大,溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
10.500mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量浓度为( )
| A. | 0.6mol/L | B. | 0.7mol/L | C. | 1.2mol/L | D. | 1.0mol/L |
11.根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c═4.18×10-3 kJ•g-1•℃-1,则该反应的中和热为△H=55.16.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 常温常压下,11.2L H2所含的原子数目小于NA | |
| C. | 0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA个 |
2.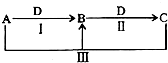 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )| A. | 若A为碳单质,则B可以用来灭火 | |
| B. | 若A为AlCl3,D为NaOH,则反应Ⅲ发生的是盐类双水解 | |
| C. | 若A为烧碱,D为CO2,则C的水溶液呈碱性 | |
| D. | 若A为氯水,D为日常生活中用途最广的金属单质,则I、Ⅱ、Ⅲ均是氧化还原反应 |
3.下列说法正确的是( )
| A. | 人类在研究物质微观结构过程中,电子显微镜、光学显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了应用 | |
| B. | 意大利科学家阿佛加德罗在1888年总结出平衡移动原理 | |
| C. | 用于比色分析的分光光度计可用来测定反应速率 | |
| D. | pH试纸有广范和精密两种,广范pH试纸测量范围较广,测量精度较高 |

 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题