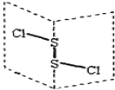
题目内容
【题目】实验室用铜制备CuSO 4 溶液有多种方案,某实验小组给出了以下三种方案:
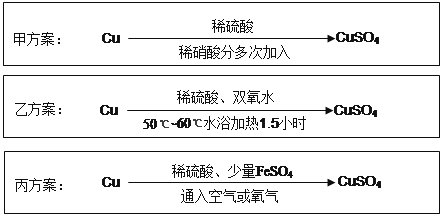
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H 2 SO 4 ):n(HNO 3 )= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L -1 的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO 4·5H 2O 20.0g【已知有关摩尔质量:M(Cu)=64g/mol, M(CuSO4·5H 2 O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H 2 O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO 4 ,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO
B.NaOH
C.CuCO 3
D.Cu 2(OH)2CO 3
E.Fe2(SO4) 3
②反应中加入少量FeSO 4 可加速铜的氧化,FeSO 4 的作用是 ;
反应过程中的的离子方程式为: 、
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。
【答案】(1)①3Cu+8H + +2NO 3 - =3Cu 2+ +2NO↑+4H 2O;②3:2;
(2)①双氧水受热易分解造成损耗; ②80%;
(3)①CD;②作催化剂;4Fe2++4H++O2=4Fe3++2H2O;2Fe3++ Cu= 2 Fe2+ +Cu2+;(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)。
【解析】
试题分析:(1)①NO3-在酸性条件下具有强氧化性,离子反应方程式为:3Cu + 8H + + 2NO3- = 3Cu2 + + 2NO↑ + 4H2O;②按照离子反应方程式的系数投入,需要HNO3提供2molNO3-和2molH + ,,即需要硝酸2mol,硫酸3mol,因此两者的比值为3:2;
(2)①过氧化氢受热易分解,因此温度不宜过高;②乙方案发生反应方程式为:Cu + H2O2 + H2SO4 = CuSO4 + 2H2O,根据反应方程式系数,推出铜丝完全反应,因此理论上产生CuSO4·5H2O的质量为6.4×250/64g = 25g,产率20/25×100% = 80%;
(3)①物质A是调节pH,不能引入新杂质,因此选项C、D正确;②Fe2 + 具有还原性,能被氧气氧化,发生4Fe2 + + O2 + 4H + = 4Fe3 + + 2H2O,铜单质和Fe3 + 反应,发生Cu + 2Fe3 + = 2Fe2 + + Cu2 + ,因此FeSO4为催化剂;
(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。