题目内容
6. 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:(1)写出反应的离子方程式Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
(2)下列三种情况下,离子方程式与(1)相同的是A(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的曲线表示是C(填序号).
(3)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O.
分析 (1)氢氧化钡与硫酸反应生成硫酸钡沉淀;
(2)A.NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,反应生成硫酸钠、硫酸钡和水;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,反应生成硫酸钡、氢氧化钠和水;
加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强;
(3)有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应,反应生成硫酸钡、偏铝酸钾和水.
解答 解:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(2)A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A正确;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故B错误;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故C错误;
加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强,图中只有C符合,
故答案为:A;C;
(3)Ba(OH)2溶液中加入KAl(SO4)2溶液至Ba2+恰好完全反应,离子方程式为:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,故答案为:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O.
点评 本题为综合题,侧重考查离子反应方程式的书写,为高考常见的题型,涉及与量有关的离子反应、导电性等,把握反应的实质即可解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 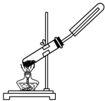 用氯化铵和氢氧化钙固体制NH3 | |
| B. | 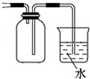 收集NH3并吸收尾气 | |
| C. | 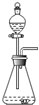 用H2O2和MnO2制取O2 | |
| D. | 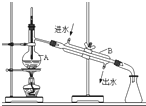 用蒸馏法分离沸点不同且互溶的液体混合物 |
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 四氯化锗与四氯化碳分子都是三角锥型 | |
| C. | 二氧化锗与二氧化碳都是非极性的气体化合物 | |
| D. | 锗和碳都存在具有原子晶体结构的单质 |
不饱和度(Ω)=双键数+叁键数×2+环数.例如:
 Ω=2.则有关下面有机物
Ω=2.则有关下面有机物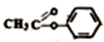 的说法正确的是( )
的说法正确的是( )| A. | 不饱和度为5 | |
| B. | 含有的官能团有碳碳双键和酯基 | |
| C. | 该有机物可以发生水解反应,不能发生氧化反应 | |
| D. | 该有机物所有原子都在同一平面上 |
| A. | 能使pH试纸呈红色的溶液:CH3COOH、NH4+、I-、NO3- | |
| B. | pH=14的溶液:Ba2+、Mg2+、HCO3- | |
| C. | c(Fe3+)=0.1mol/L的溶液:H+、Al3+、Cl-、SCN- | |
| D. | kw/c(H+)=0.1mol/L的溶液:Na+、NH3•H2O、SiO32-、NO3- |
| A. | K+、Cu2+、Na+、Cl- | B. | K+、Na+、NO3-、CO32- | ||
| C. | Na+、HCO3-、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
| A. | 加热碘,收集到紫黑色固体 | |
| B. | 将NaCl固体溶于水后离子键被破坏 | |
| C. | 将CCl4加入溴水中,观察到CCl4成橙色 | |
| D. | 将H2O2滴加在MnO2中,可收集到无色气体 |
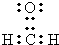 .A中所有原子是否共面是(填“是”或“否”).
.A中所有原子是否共面是(填“是”或“否”).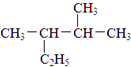 :2,3-二甲基戊烷;②
:2,3-二甲基戊烷;②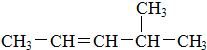 :4-甲基-2-戊烯.
:4-甲基-2-戊烯.