题目内容
5.某恒温密闭容器中,可逆反应A(s)?B+C(g)-Q达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )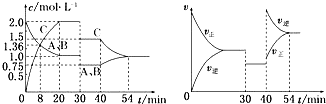
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q |
分析 A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、保持体积不变,若B为气态,则向平衡体系中加入B,平衡逆向移动;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
解答 解:A、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故A错误;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,故B正确;
C、保持体积不变,A为固体,固体不影响平衡,则向平衡体系中加入A,平衡不移动,故C错误;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选B.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解为解题关键,题目难度中等.

练习册系列答案
相关题目
15.设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 含有1mol Na2SO4的溶液中,含有的Na+个数为NA | |
| B. | 18g水中含有电子数为8NA | |
| C. | 标准状况下,22.4LH2含有氢原子个数为2NA | |
| D. | 1.2L H2一定含有NA个氢原子 |
13.下列各项正确的是( )
| A. | 钠与水反应的离子方程式:Na+H2O═Na++OH-+H2↑ | |
| B. | 铁与水蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| C. | 镁、铝与沸水不可能反应 | |
| D. | 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+═2Na++Cu |
20.下列离子方程式不正确的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫:2 CO32-+SO2+H2O=2 HCO3-+SO32- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-沉淀完全:2Ba2++NH4++Al3++2 SO42-+4OH-=Al(OH)3↓+2BaSO4↓+NH3•H2O | |
| C. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| D. | 将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6 AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
10.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属钒 | ||
| C. | 用石灰石、纯碱、二氧化硅制玻璃 | D. | 电解饱和食盐水制烧碱 |
17.下列物质分子的几何构型为正四面体的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
14.下列叙述中,不属于核外电子的特点的是( )
| A. | 质量很小 | B. | 运动范围很小 | ||
| C. | 运动速率很快 | D. | 有确定的运动轨道 |