题目内容
【题目】常温下,向20.00mL0.1mol/L的MOH溶液逐滴加入一定浓度的HA溶液滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和。则下列说法错误的是
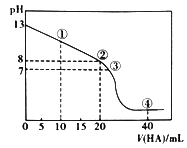
A. ②点混合溶液中水电离出的c(H+)大于HA溶液中由水电离出的c(H+)
B. ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-)
C. 酸HA溶液的浓度为0.1mol/L
D. ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-)
【答案】D
【解析】A、MOH的起始浓度是0.1mol·L-1,如果MOH是强碱,其pH=13,与图像的起点吻合,说明MOH是强碱,②点对应的pH=8,说明MOH恰好被中和,此时的溶质是MA,溶液显碱性,说明A-发生水解造成的,水解促进水的电离,HA是酸,抑制水的电离,故A说法正确;B、③点根据电荷守恒,c(M+)+c(H+)=c(OH-)+c(A-),因为③点对应的pH=7,c(H+)=c(OH-),即c(M+)=c(A-),离子浓度大小顺序是c(M+)=c(A-)>c(H+)=c(OH-),故B说法正确;C、当加入20mL的HA时,恰好完全反应,20×10-3×c(HA)=20×10-3×0.1,即c(HA)=0.1mol·L-1,故C说法正确;D、④点加入HA的体积为40mL,此时溶液中溶质为MA和HA,且两者物质的量相等,根据电荷守恒:c(M+)+c(H+)=c(OH-)+c(A-),根据物料守恒:2c(M+)=c(A-)+c(HA),两式联立解得,c(H+)+c(HA)=c(M+)+c(OH-),故D说法错误。

【题目】汽车尾气脱硝脱碳主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
C(NO)/mol L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
C(CO)/mol L-1 | 9.00×10-3 | 4.00×10-3 | 2. 00×10-3 | 1.00×10-3 | .1.00×10-3 |
下列说法正确的是
A. —定温度下,从开始到平衡,该反应的平衡常数逐渐增大
B. 前2s内的平均反应速率v(N2) = 1.75×10-3 mol·L-1·s-1
C. 达到平衡时,CO的转化率为11. 11%
D. 3s时NO和CO的浓度都不再变化,反应停止进行