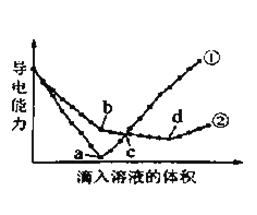
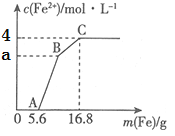
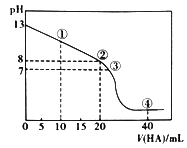
题目内容
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
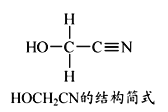
4HCHO+[Zn(CN)4]2-+4H++4H2O=== [Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为 ________。
(2)1 mol HCHO分子中含有σ键的数目为_______mol。
(3)HOCH2CN分子中碳原子轨道的杂化轨道类型是________。
(4)与H2O分子互为等电子体的阴离子为_____________。
(5)C、N、O第一电离能由小到大的顺序__________。
(6)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
【答案】 ![]() 3
3 ![]() NH2- C<O<N
NH2- C<O<N 
【解析】(1)Zn为30号元素,失去最外层的2个电子后, Zn2+核外有28个电子,所以其基态核外电子排布式为![]() 。
。
(2)1 mol HCHO分子中有2个碳氢键和1个碳氧双键,所以含有σ键的数目为3mol。
(3)HOCH2CN分子中有2个碳原子,其中一个与其也原子形成了四个单键,另一个与其他原子形成了2个单键和1个叁键,所以碳原子轨道的杂化轨道类型是![]() 。
。
(4)H2O分子中有3个原子,价电子总数为8个,所以与H2O分子互为等电子体的阴离子为![]() 。
。
(5)C、N、O第一电离能由小到大的顺序C<O<N。
(6)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为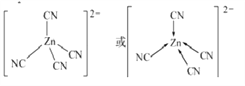 。
。

练习册系列答案
相关题目