题目内容
国家环保总局“环境监测公报”指出,减少SO2的排放和生活废水的处理是
我国“十一五”期间环境保护的主要任务.请回答下列问题:
 (1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是______.
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+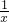 Sx、CO+
Sx、CO+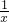 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+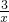 Sx.其中COS(羰基硫)分子的电子式为______.
Sx.其中COS(羰基硫)分子的电子式为______.
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为______.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式______.
解:(1)某地区酸雨pH随时间的变化分析,随时间增长,溶液PH减小,证明氢离子浓度增大,酸雨形成是二氧化硫溶于水生成亚硫酸,亚硫酸钡氧气氧化为硫酸,从弱酸变化为强酸,溶液中氢离子浓度增大,PH减小,反应的化学方程式为:2H2SO3+O2=2H2SO4;故答案为:2H2SO3+O2=2H2SO4;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染;
故答案为:既能回收利用SO2,又能得到复合肥磷铵;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价,结合原子结构写出电子式为: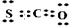 ;
;
故答案为: ;
;
(4)氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用,常见的能使生活污水中悬浮物聚沉的物质有明矾、绿矾高铁酸盐等;消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液是硝酸溶液,具有强氧化性,加入甲醇,硝酸根离子和氢离子能氧化甲醇为无毒气体为二氧化碳,NO3-和甲醇转化为两种无毒气体,推断硝酸钡还原为氮气,反应的离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
故答案为:KAl(SO4)2?12H2O或 FeSO4?7H2O; 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
分析:(1)依据PH变化图象分析,酸雨的形成过程分析,酸雨形成的主要因素是二氧化硫溶于水生成亚硫酸,亚硫酸钡氧化为硫酸的过程,随时间增长,PH减小,标明亚硫酸钡氧气氧化为硫酸;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价;
(4)依据氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用分析选择试剂;依据题干信息结合物质组成元素分析判断生成无毒气体为二氧化碳和氮气,结合原子守恒写出化学方程式;
点评:本题考查了酸雨形成的过程分析,二氧化硫吸收方法应用,电子式的书写,盐类水解,氧化还原反应的发消息判断,题目难度中等.
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染;
故答案为:既能回收利用SO2,又能得到复合肥磷铵;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价,结合原子结构写出电子式为:
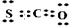 ;
;故答案为:
 ;
;(4)氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用,常见的能使生活污水中悬浮物聚沉的物质有明矾、绿矾高铁酸盐等;消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液是硝酸溶液,具有强氧化性,加入甲醇,硝酸根离子和氢离子能氧化甲醇为无毒气体为二氧化碳,NO3-和甲醇转化为两种无毒气体,推断硝酸钡还原为氮气,反应的离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
故答案为:KAl(SO4)2?12H2O或 FeSO4?7H2O; 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
分析:(1)依据PH变化图象分析,酸雨的形成过程分析,酸雨形成的主要因素是二氧化硫溶于水生成亚硫酸,亚硫酸钡氧化为硫酸的过程,随时间增长,PH减小,标明亚硫酸钡氧气氧化为硫酸;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价;
(4)依据氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用分析选择试剂;依据题干信息结合物质组成元素分析判断生成无毒气体为二氧化碳和氮气,结合原子守恒写出化学方程式;
点评:本题考查了酸雨形成的过程分析,二氧化硫吸收方法应用,电子式的书写,盐类水解,氧化还原反应的发消息判断,题目难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目


 下列有关实验原理或实验操作正确的是
下列有关实验原理或实验操作正确的是