题目内容
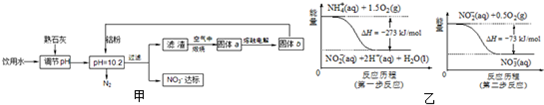
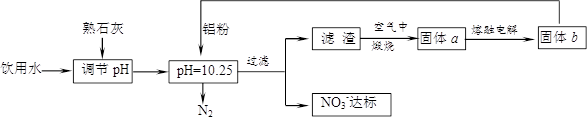
饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能.为了降低饮用水中NO3-的浓度,某兴趣小组提出如图甲方案:
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为______.
(2)该方案中选用熟石灰调节pH,理由是______、______,在调节pH时,若pH过大或过小都会造成______的利用率降低.
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为______.
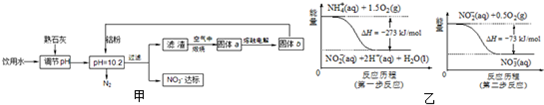
(4)饮用水中的NO3- 主要来自于NH4+.已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图乙:试写出1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是______.
解:(1)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3-反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:来源丰富、价格便宜;引入的Ca2+对人体无害;铝;
(3)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3- N2+4H2O+2OH-,
N2+4H2O+2OH-,
故答案为:5H2+2NO3-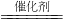 N2+4H2O+2OH-;
N2+4H2O+2OH-;
(4)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-2736 kJ?mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ?mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ?mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ?mol-1.
分析:(1)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气;
(2)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应;
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气;
(4)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-2736 kJ?mol-1,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ?mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式.
点评:本题以信息的形式考查氧化还原反应、离子反应及热化学反应,注重对化学用语的考查,注意知识与题目信息的结合来解答,对学生能力要求较高,题目难度中等.
故答案为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:来源丰富、价格便宜;引入的Ca2+对人体无害;铝;
(3)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-
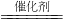 N2+4H2O+2OH-,
N2+4H2O+2OH-,故答案为:5H2+2NO3-
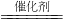 N2+4H2O+2OH-;
N2+4H2O+2OH-;(4)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-2736 kJ?mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ?mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ?mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ?mol-1.
分析:(1)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气;
(2)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应;
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气;
(4)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-2736 kJ?mol-1,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ?mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式.
点评:本题以信息的形式考查氧化还原反应、离子反应及热化学反应,注重对化学用语的考查,注意知识与题目信息的结合来解答,对学生能力要求较高,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目