题目内容
【题目】室温下,向100 mL某浓度H2A溶液中加入0.1 mol·L-1 NaOH溶液,所得溶液的pH随NaOH溶液体积的变化曲线如图所示,其中b、c为等当点(等当点指的是按某个方程式恰好反应的点)。下列有关说法不正确的是

A. 起始时,c(H2A)=0.1 mol·L-1
B. b点时:c(Na+)> c(A2-)>c(HA-) > c(H+)>c(OH-)
C. b→c段,反应的离子方程式为HA-+OH-===A2-+H2O
D. c→d段,溶液中A2-的水解程度逐渐减弱
【答案】B
【解析】
A.曲线中有两个突跃范围,故为二元弱酸,当滴加NaOH溶液体积为100mL时达到第一个计量点,故n(H2A)=0.1mol![]() L-1
L-1![]() L=0.01 mol,所以起始时,c(H2A)=0.01 mol/0.1L=0.1mol
L=0.01 mol,所以起始时,c(H2A)=0.01 mol/0.1L=0.1mol![]() L-1,故A正确;B.b点为NaHA溶液,显酸性,则HA-的电离程度大于水解程度,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B项错误;C. a→b段发生反应H2A+NaOH=NaHA+H2O,b-→c段发生反应NaHA+NaOH=Na2A+H20,离子方程式为:HA-+OH-===A2-+H2O,C项正确;D.c点时H2A与NaOH恰好完全中和,得Na2A溶液,c-→d段是向Na2A溶液中继续滴加NaOH溶液,c(OH-)增大,抑制A2-的水解,D项正确。答案:B。
L-1,故A正确;B.b点为NaHA溶液,显酸性,则HA-的电离程度大于水解程度,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B项错误;C. a→b段发生反应H2A+NaOH=NaHA+H2O,b-→c段发生反应NaHA+NaOH=Na2A+H20,离子方程式为:HA-+OH-===A2-+H2O,C项正确;D.c点时H2A与NaOH恰好完全中和,得Na2A溶液,c-→d段是向Na2A溶液中继续滴加NaOH溶液,c(OH-)增大,抑制A2-的水解,D项正确。答案:B。

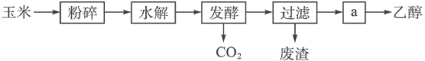
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对废旧碱性锌锰干电池的资源进行回收:

已知:
①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
③ 0.1 mol/L NaHCO3溶液的pH约为8;0.1 mol/L Na2CO3溶液的pH约为11。
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为:2MnO2+Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式________________________________;
(2)为了提高碳包的浸出效率,可以采取的措施有______________________________;(写一条即可)
(3)向滤液1中加入MnS的目的是__________________________________________;
(4)已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;

(5)为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如下表,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式________________。
实验编号 | 试剂X | MnSO4/g |
1 | 锌粉 | 2.4 |
2 | 铁粉 | 2.7 |
3 | FeS粉末 | 3.0 |
4 | 30%过氧化氢 | 3.7 |
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是_______________________________________;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定,测定Mn元素在电池中的质量百分数。
实验过程如下:
①将一节废旧碱性锌锰干电池拆解后,去除金属、碳棒以及外包装后;
②准确称取固体粉末1.200 g;
③经过水浸…等步骤得到滤液1(<100 mL);
④将滤液1稀释至100.00 mL;
⑤取20.00 mL溶液用0.0500 molL-1EDTA标准溶液滴定;在一定条件下,只发生反应:Mn2++Y2-=MnY。
⑥重复滴定3次,平均消耗标准溶液22.00 mL。
则Mn元素的质量百分数为________。(保留3位有效数字)