题目内容
【题目】目前,我国已经有上百个地区的加油站可提供标号为E90、E93的乙醇汽油,它们是在90#、93#汽油中加入了一定量的乙醇而制得。
(1)用玉米生产燃料乙醇的生产如下图表示:
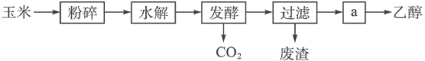
①粉碎玉米的目的是____。步骤a的操作是___。
②以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+ nH2O![]() nC6H12O6
nC6H12O6
C6H12O6![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
100 kg玉米淀粉最多可生产无水乙醇____kg。
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,可能出现______现象。
(3)常温下,1g乙醇完全燃烧释放29.71kJ热量,请写出乙醇完全燃烧的热化学方程式______。
(4)由玉米等农产品为原料制得的乙醇作燃料,是否是增加大气中CO2的含量,为什么?______。
【答案】增大反应物间的接触面积,加快反应速率,提高原料利用率 蒸馏 56.8 分层 CH3CH2OH(l)+ 3O2(g)= 2CO2(l)+ 3H2O(l) △H=-1366.7kJ·mol—1 不会,以1mol (C6H10O5)n计,光合作用合成时可吸收6n mol CO2,(C6H10O5)n发酵及生成的C2H5OH燃烧共向大气中排放6 n mol CO2,所以不会增加大气中CO2的含量
【解析】
根据题目提供的信息条件及相关化学知识可以判断:
(1)①粉碎玉米的目的是为了增大反应物的接触面积,从而加快反应速率或使反应进行的更充分;步骤a从溶液中得到乙醇,应利用沸点的不同进行分离,操作是蒸馏;
②根据题目提供的反应关系得到如下关系:
(C6H10O5)n~nC6H12O6 ~ 2nC2H5OH
162n 92n
100kg m(C2H5OH)
![]() =
=![]() ,解得m(C2H5OH)=56.8 kg
,解得m(C2H5OH)=56.8 kg
即答案为56.8;
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,汽油中会出现液体分层的现象,原因是汽油与水互不相溶;
(3)燃烧热是指:在25℃、101kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.71kJ,则1mol乙醇(质量为46g),完全燃烧生成稳定的氧化物放出的热量为46×29.71kJ=1366.7kJ,其燃烧热的热化学方程式为:CH3CH2OH(l)+ 3O2(g)= 2CO2(l)+ 3H2O(l) △H=-1366.7kJ·mol—1;
(4)由玉米等农产品为原料制得的乙醇作燃料,以1mol (C6H10O5)n计,光合作用合成时可吸收6n mol CO2,(C6H10O5)n发酵及生成的C2H5OH燃烧共向大气中排放6 n mol CO2,所以不会增加大气中CO2的含量。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快