题目内容
【题目】在一容积可变的密闭容器中,充入一定量的H2和I2(g)发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
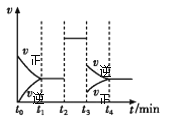
A.t0—t2时段,H2的浓度不变即体系达到平衡
B.t2时,改变的条件只有加入催化剂才能实现
C.在t4所处的平衡体系中,再加入H2,I2(g)的转化率增大
D.HI的体积分数最高的时段是t1—t2
【答案】B
【解析】
A选项,t0—t2时段,氢气浓度开始减少,当H2的浓度不变即体系达到平衡,故A正确;
B选项,t2时,改变条件反应速率加快、但平衡不移动,改变的条件可能为:加入催化剂或加压,故B错误;
C选项,在t4所处的平衡体系中,再加入H2,平衡正向移动,I2(g)的转化率增大,故C正确;
D选项,t2时改变条件,平衡不移动,t3时改变条件,平衡逆向移动,因此HI的体积分数最高的时段是t1—t2,故D正确。
综上所述,答案为B。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
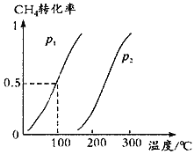
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D