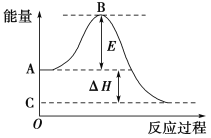
题目内容
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和反应速率的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.单位时间内消耗1 molNH2COONH4 ,同时生成2mol NH3
F.密闭容器中混合气体的平均摩尔质量不变 G.容器内NH3与CO2的浓度之比为2∶1 H.6个N—H键断裂的同时,有2个C=O键形成
(2)根据表中数据,计算25.0 ℃时的分解平衡常数______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)
【答案】 BCH K=c2(NH3)·c(CO2)=(![]() c)2·(
c)2·(![]() c)=
c)=![]() ×(4.8×10-3 mol·L-1)3≈1.6×10-8(mol·L-1)3 增加
×(4.8×10-3 mol·L-1)3≈1.6×10-8(mol·L-1)3 增加
【解析】(1)根据达到平衡状态的特征:各组分浓度不再变化,正逆反应速率相等进行判断;
(2)根据化学平衡常数的表达式进行计算;
(3)根据平衡移动原理判断。
(1)A、不能表示正、逆反应速率相等,不能判断化学反应是否达到平衡,故A错误;
B、由于正反应方向气体分子数增大,则密闭容器中压强不变,反应达到平衡,故B正确;
C、恒容,若平衡发生移动,则混合气体密度发生改变,故C正确;
D、反应物是固体,NH3的体积分数始终为![]() ,故D错误;
,故D错误;
E. 由方程式可知,单位时间内消耗1 molNH2COONH4 一定生成2mol NH3,不能判断化学反应是否达到平衡,故E错误;
F.混合气体中氨气和二氧化碳体积比为2:1,组成一定,平均摩尔质量始终不变,不能判断化学反应是否达到平衡,故F错误;
G.容器内NH3与CO2的浓度之比为2∶1 是定值,不能判断化学反应是否达到平衡,故G错误;
H.6个N—H键断裂的同时有2个C=O键形成,说明正、逆反应速率相等,化学反应已达到平衡,故H正确。
因此,本题答案为:BCH;
(2)需将25 ℃的总浓度转化为NH3和CO2的浓度:c(NH3)=![]() ×4.8×10-3mol·L-1=3.2×10-3mol·L-1,c(CO2)=
×4.8×10-3mol·L-1=3.2×10-3mol·L-1,c(CO2)=![]() ×4.8×10-3mol·L-1=1.6×10-3mol·L-1,K=(3.2×10-3)2×1.6×10-3≈1.6×10-8;
×4.8×10-3mol·L-1=1.6×10-3mol·L-1,K=(3.2×10-3)2×1.6×10-3≈1.6×10-8;
(3)压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加。