��Ŀ����
��ҵ�Ϻϳɰ���ԭ��֮һ������������һ����Դ��ʯ�������������������������������ش��������⣺(1)������������·�Ӧ;�������跴Ӧ���ܽ��У�����Ϊ���������( )
A.C3H8![]() 3C+4H2
3C+4H2
B.C3H8![]() C3H6+H2
C3H6+H2
C.C3H8+6H2O![]() 3CO2+10H2
3CO2+10H2
D.3C3H8+10O3![]() 9CO2+12H2O
9CO2+12H2O
2H2O![]() 2H2��+O2��
2H2��+O2��
(2)������������ķ�Ӧ;������������1 mol������Ƶð�( )
A.4 mol B.6.7 mol C.10 mol D.2.7 mol
(3)�ú����ķ�Ӧ;�����������ŵ���( )
A.������ B.�Ƶõ�H2���ȸ�
C.��ȡ��H2������ D.��ͬʱ��ô�������
������(1)�������Ӧ����H2�����ԭ�������ʸߣ����ʸߡ�
(2)1 mol C3H8��H2 10 mol��
10 mol H2ȫ��ת��ΪNH3��ӦΪ![]() =6.7 mol��
=6.7 mol��
(3)���������ŵ��Dz����ߣ���;��A��B���������C3H8�����ʲ���λ����D����������H2O������H2�����˷���Դ�IJ���ȡ��;����
�𰸣�(1)C (2)B (3)C

��ϰ��ϵ�д�
�����Ŀ

 CO��g��+3H2��g������H=+QkJ/mol��Q��0��
CO��g��+3H2��g������H=+QkJ/mol��Q��0��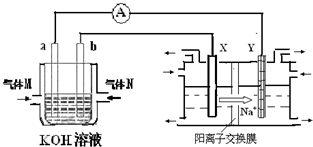 ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ� ��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
 2NH3 (g) ��H����92.2kJ��mol��1
2NH3 (g) ��H����92.2kJ��mol��1