题目内容
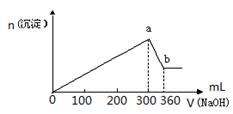
(8分)取100mL FeCl3、AlCl3的混合溶液,逐滴加入物质的量浓度为1 mol·L-1的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积(单位为mL)关系如下图所示。
按要求回答:
(1)a点对应沉淀的物质的量是 mol;此时溶液中的溶质是 。
(2)b点对应沉淀的物质的量是 mol;原溶液中c(AlCl3)= mol·L-1。

按要求回答:
(1)a点对应沉淀的物质的量是 mol;此时溶液中的溶质是 。
(2)b点对应沉淀的物质的量是 mol;原溶液中c(AlCl3)= mol·L-1。
(8分,每空2分)
(1) 0.1; NaCl,
(2) 0.04; 0.6
(1) 0.1; NaCl,
(2) 0.04; 0.6
试题分析:(1)a点对应沉淀是沉淀的最大量,根据元素守恒,氢氧化铁和氢氧化铝沉淀中氢氧根离子是沉淀物质的量的3倍,所以沉淀的物质的量是氢氧化钠物质的量的1/3,300mL的氢氧化钠的物质的量是0.3mol,所以a点对应沉淀的物质的量是0.1mol,此时溶液中的溶质是NaCl;
(2)b点对应沉淀是氢氧化铁沉淀,氢氧化铝沉淀与60mL的氢氧化钠溶液反应,根据Al(OH)3~OH-,判断氢氧化铝沉淀的物质的量是0.06L×1 mol·L-1=0.06mol,所以b点对应沉淀的物质的量是0.1mol-0.06mol=0.04mol;根据铝元素守恒,原溶液中n(AlCl3)=0.06mol,则c(AlCl3)=0.06mol/0.1L=0.6mol/L.。

练习册系列答案
相关题目