题目内容
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
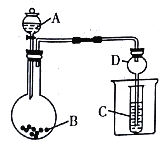
A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3 溶液,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,两者混合后产生NH3,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解
D. 仪器D可以起到防止溶液倒吸的作用
【答案】C
【解析】A、若A为浓盐酸,B为KMnO4,常温下反应生成Cl2,Cl2进入C装置溶于水,生成具有漂白性的HClO,使品红褪色,故A正确;B、若A为醋酸,B为贝壳(主要成分为碳酸钙),可生成CO2,与C中Na2SiO3反应,生成H2SiO3沉淀,溶液变浑浊,故B正确;C、向生石灰中滴加浓氨水,生石灰吸水放出大量的热,促进浓氨水分解,产生NH3,NH3与C中AlCl3反应生成Al(OH)3,而Al(OH)3不溶于氨水,所以现象为产生白色沉淀,故C错误;D、D为球形干燥管,球形结构可使倒吸的液体受重力作用流下,具有防倒吸作用,故D正确。故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
KW/10﹣14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因:
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为mol/L
③10℃时纯水的电离平衡常数为 .
