题目内容
8.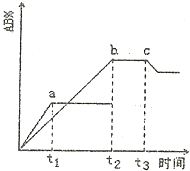 反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中有一种为非气体,Q>0 | |
| C. | AB为气体,A2、B2中有一种为非气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
分析 由图象可知,升高温度AB的含量减小,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,从时间t3开始向容器中加压,AB的含量减小,说明平衡向逆反应方向进行,说明反应物气体的化学计量数之和小于生成物化学计量数,则AB为气体,A2、B2中至少有一种为非气体.
解答 解:升高温度AB的含量减小,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,则△H<0,即Q<0;
从时间t3开始向容器中加压,AB的含量减小,说明平衡向逆反应方向进行,说明反应物气体的化学计量数之和小于生成物化学计量数,则AB为气体,A2、B2中至少有一种为非气体,如都为气体,增大压强平衡不移动,
故选C.
点评 本题考查化学平衡图象问题,题目难度中等,解答本题的关键是根据图象的变化曲线判断温度、越强对平衡移动的影响.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
19.江苏省已开始大力实施“清水蓝天”工程.下列不利于“清水蓝天”工程实施的是( )
| A. | 将废旧电池深埋,防止污染环境 | |
| B. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
16.两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为( )
| A. | 3:2 | B. | 2:1 | C. | 8:1 | D. | 2:9 |
13.已知H2CO3?H++HCO${\;}_{3}^{-}$,K1=4.3×10-7,HCO3-?H++CO32-,K2=5.6×10-11;HClO?H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是( )
| A. | Ca(ClO)2+2HCl═CaCl2+2HClO | B. | Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2HCl | ||
| C. | NaClO+H2O+CO2═NaHCO3+HClO | D. | 2NaClO+H2O+CO2═Na2CO3+2HClO |
18.第ⅠA族的两种元素的原子序数之差不可能是( )
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
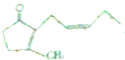 ),其香味浓郁,被广泛应用于化妆品的制造中.
),其香味浓郁,被广泛应用于化妆品的制造中.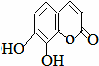 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.